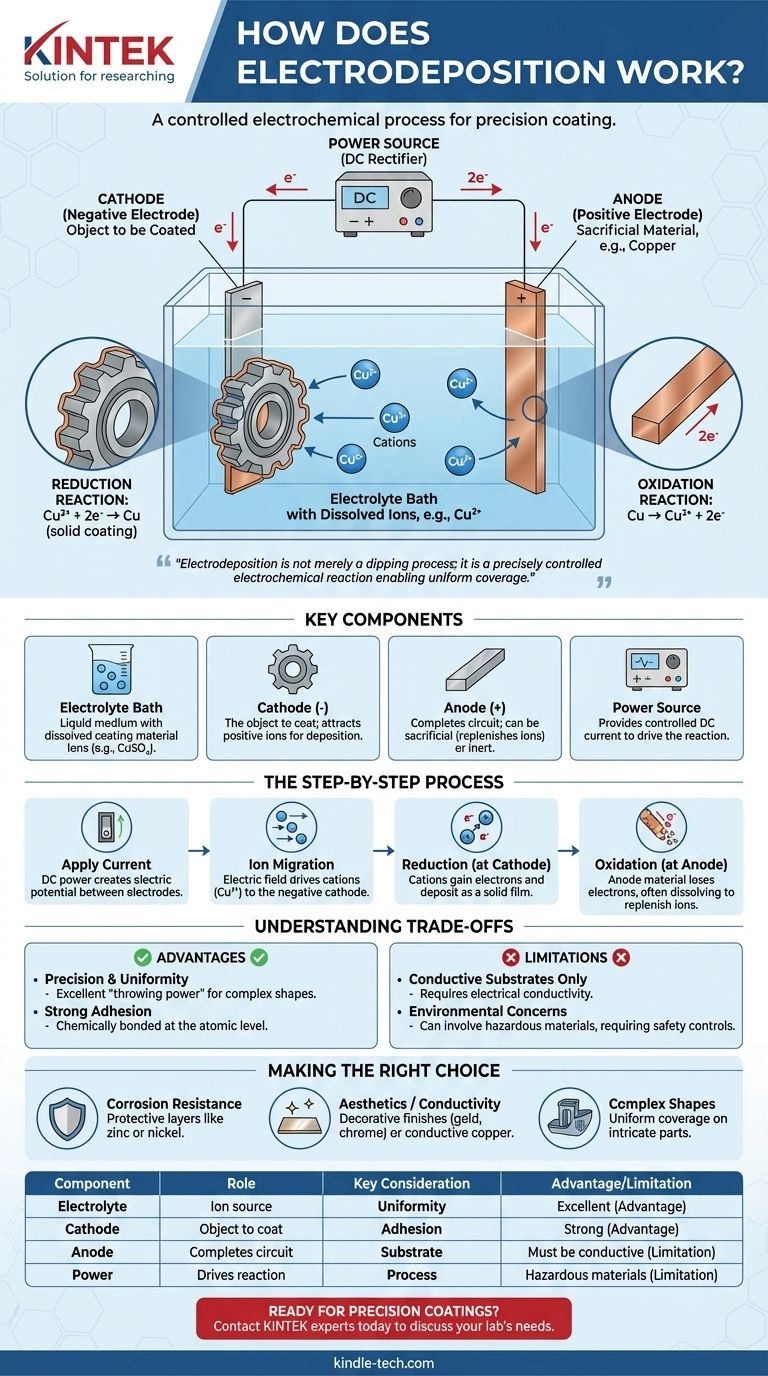
À la base, l'électrodéposition est un processus qui utilise un courant électrique pour recouvrir un objet conducteur d'une fine couche de matériau. Ceci est réalisé en immergeant l'objet (la cathode) et une seconde électrode (l'anode) dans une solution chimique, ou bain électrolytique, contenant des ions dissous du matériau de revêtement. Lorsqu'un courant continu est appliqué, ces ions sont attirés vers la surface de l'objet, où ils sont "déposés" sous forme solide, créant un film métallique ou organique uniforme et adhérent.
L'idée cruciale est que l'électrodéposition n'est pas simplement un processus de trempage ; c'est une réaction électrochimique précisément contrôlée. Le champ électrique dicte où et comment le revêtement se forme, permettant une couverture uniforme même des formes les plus complexes avec une couche dont l'épaisseur est directement proportionnelle au courant appliqué et au temps.

Les composants clés de la cellule d'électrodéposition
Pour comprendre le processus, vous devez d'abord comprendre ses composants fondamentaux. Chaque installation d'électrodéposition, d'un bécher de laboratoire à une cuve industrielle, se compose de quatre parties essentielles travaillant de concert.
Le bain électrolytique
L'électrolyte est le milieu liquide qui facilite l'ensemble du processus. C'est une solution, généralement à base d'eau, contenant des sels dissous du matériau à déposer. Par exemple, dans le placage de cuivre, le bain contiendrait un sel comme le sulfate de cuivre (CuSO₄), qui fournit les ions cuivre (Cu²⁺).
La cathode (électrode négative)
C'est l'objet que vous avez l'intention de recouvrir. Elle est connectée à la borne négative de l'alimentation électrique. La charge négative sur sa surface est ce qui attire les ions métalliques chargés positivement du bain électrolytique.
L'anode (électrode positive)
Connectée à la borne positive de l'alimentation électrique, l'anode complète le circuit électrique. Les anodes peuvent être soit "sacrificielles", faites du même matériau que le revêtement, se dissolvant pour reconstituer les ions dans le bain, soit "inertes", faites d'un matériau non réactif comme le platine ou le carbone.
La source d'alimentation
Une alimentation en courant continu (CC), telle qu'un redresseur, fournit l'énergie électrique nécessaire pour entraîner la réaction. La tension et le courant sont soigneusement contrôlés pour gérer le taux et la qualité du dépôt.
Le processus électrochimique étape par étape
Avec les composants en place, le processus se déroule comme une séquence contrôlée d'événements électrochimiques.
Application du courant
Au moment où l'alimentation CC est activée, un potentiel électrique est établi entre l'anode et la cathode. Cela crée un champ électrique dans tout le bain électrolytique.
Migration des ions
Sous l'effet de ce champ électrique, les particules chargées (ions) en solution commencent à se déplacer. Les ions chargés positivement, appelés cations (par exemple, Cu²⁺), sont attirés par la cathode chargée négativement (la pièce à usiner).
La réaction de réduction à la cathode
C'est le cœur du processus de revêtement. Lorsque les cations atteignent la surface de la cathode, ils gagnent des électrons. Ce processus chimique est appelé réduction. Le gain d'électrons neutralise leur charge, les faisant se déposer sur la surface sous forme de film métallique solide.
Pour le cuivre, la réaction est : Cu²⁺ (en solution) + 2e⁻ → Cu (revêtement solide)
La réaction d'oxydation à l'anode
Simultanément, une réaction correspondante appelée oxydation se produit à l'anode, où une substance perd des électrons. Si une anode sacrificielle est utilisée, elle se dissout lentement dans le bain, reconstituant les ions métalliques qui ont été déposés sur la cathode et assurant un processus stable.
La réaction de l'anode sacrificielle en cuivre est : Cu (anode solide) → Cu²⁺ (en solution) + 2e⁻
Comprendre les compromis
Bien que puissante, l'électrodéposition n'est pas une solution universelle. Comprendre ses avantages et ses limites est essentiel pour son application correcte.
Avantage : Précision et uniformité
La principale force de l'électrodéposition est sa capacité à créer des revêtements très uniformes, même sur des objets aux géométries complexes, aux trous et aux surfaces internes. Ce "pouvoir de pénétration" est difficile à atteindre avec des méthodes en ligne de mire comme la peinture au pistolet.
Avantage : Forte adhérence
Parce que le revêtement est formé par une liaison électrochimique au niveau atomique, l'adhérence entre le substrat et la couche déposée est exceptionnellement forte et durable.
Limitation : Substrats conducteurs uniquement
Le processus repose fondamentalement sur la capacité de la pièce à conduire l'électricité. Les matériaux non conducteurs comme les plastiques ou les céramiques ne peuvent pas être directement recouverts sans être préalablement traités avec une couche conductrice.
Limitation : Préoccupations environnementales et de sécurité
De nombreux bains électrolytiques industriels contiennent des matériaux dangereux, tels que des acides forts, des métaux lourds ou des cyanures. Cela nécessite des contrôles de processus stricts, un traitement spécialisé des déchets et des protocoles de sécurité robustes pour protéger les travailleurs et l'environnement.
Faire le bon choix pour votre objectif
La décision d'utiliser l'électrodéposition dépend de votre objectif technique spécifique.
- Si votre objectif principal est la résistance à la corrosion : L'électrodéposition est un excellent choix pour appliquer des couches protectrices comme le zinc (galvanisation) ou le nickel, qui créent une barrière dense et non poreuse contre les éléments.
- Si votre objectif principal est l'esthétique ou la conductivité : Le processus est idéal pour les finitions décoratives comme le chrome, l'or et l'argent, ou pour appliquer des couches très conductrices de cuivre dans la fabrication de produits électroniques.
- Si votre objectif principal est de revêtir des formes complexes et complexes : La capacité de l'électrodéposition à couvrir uniformément toutes les surfaces mouillées la rend supérieure à presque toute autre méthode pour les pièces présentant des caractéristiques internes ou externes complexes.
En maîtrisant l'interaction de la chimie et de l'électricité, l'électrodéposition offre un contrôle inégalé pour l'ingénierie d'une surface afin de répondre à un besoin spécifique.
Tableau récapitulatif :
| Composant | Rôle dans l'électrodéposition |
|---|---|
| Bain électrolytique | Solution contenant des ions dissous du matériau de revêtement. |
| Cathode | L'objet à revêtir ; attire les ions positifs. |
| Anode | Complète le circuit ; peut être sacrificielle ou inerte. |
| Source d'alimentation | Fournit le courant continu (CC) pour entraîner la réaction. |
| Considération clé | Avantage / Limitation |
|---|---|
| Uniformité du revêtement | Excellent pour les formes complexes (Avantage) |
| Adhérence | Liaison forte au niveau atomique (Avantage) |
| Substrat | Nécessite une surface conductrice (Limitation) |
| Processus | Implique des matériaux dangereux (Limitation) |
Prêt à réaliser des revêtements de précision dans votre laboratoire ?
Le processus contrôlé d'électrodéposition est essentiel pour les applications nécessitant des couches métalliques uniformes, de la protection contre la corrosion à la conductivité électronique. KINTEK est spécialisé dans la fourniture d'équipements de laboratoire fiables et de consommables dont vous avez besoin pour perfectionner vos processus d'électrodéposition en toute sécurité et efficacité.
Contactez nos experts dès aujourd'hui pour discuter de la manière dont nos solutions peuvent améliorer les capacités de votre laboratoire et vous aider à atteindre vos objectifs spécifiques de revêtement.
Guide Visuel
Produits associés
- Système d'équipement de machine HFCVD pour le revêtement de nanodiamant de filière de tréfilage
- Système de réacteur de dépôt chimique en phase vapeur assisté par plasma micro-ondes (MPCVD) pour diamant 915 MHz
- Tamis de laboratoire et machines de tamisage
- Plaquettes de coupe en diamant CVD pour l'usinage de précision
- Électrode à disque rotatif (disque-anneau) RRDE / Compatible avec PINE, ALS japonais, Metrohm suisse carbone vitreux platine
Les gens demandent aussi
- Qu'est-ce que le CVD plasma micro-ondes ? Un guide pour la synthèse de diamants et de matériaux de haute pureté
- Comment fonctionne un réacteur de dépôt chimique en phase vapeur à filament chaud (HFCVD) ? Guide expert pour la fabrication de films de diamant
- Comment l'équipement PACVD améliore-t-il les revêtements DLC ? Débloquez une faible friction et une haute résistance à la chaleur
- Qu'est-ce que le dépôt chimique en phase vapeur de diamant à filament chaud ? Un guide sur le revêtement de diamant synthétique
- Quelle est la fonction spécifique du filament métallique dans le HF-CVD ? Rôles clés dans la croissance du diamant



















