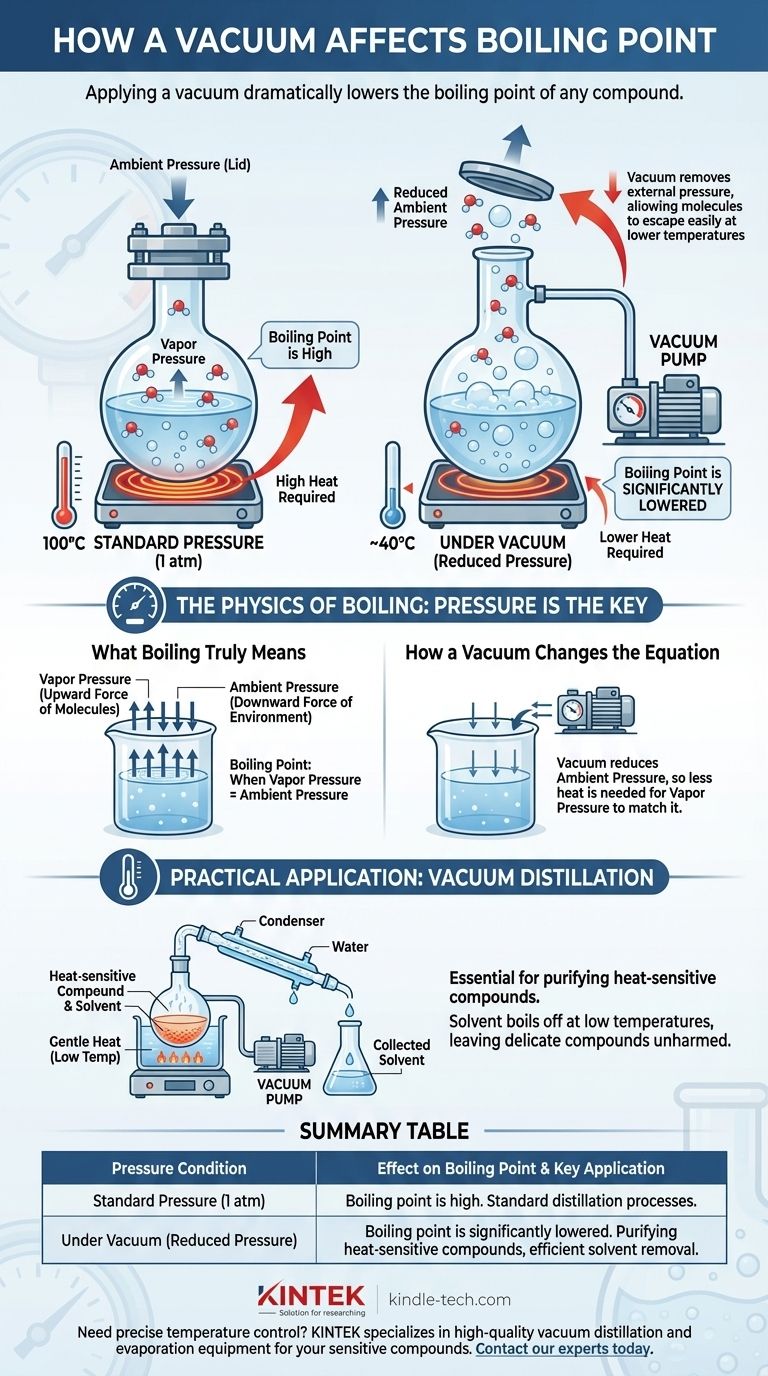
En bref, l'application d'un vide abaisse considérablement le point d'ébullition de tout composé. L'ébullition n'est pas une température fixe, mais plutôt le point où la pression de vapeur interne d'un liquide est égale à la pression externe qui s'exerce sur sa surface. En créant un vide, vous supprimez cette pression externe, ce qui facilite grandement l'échappement des molécules de la phase liquide pour se transformer en gaz à une température beaucoup plus basse.
Le point d'ébullition d'un liquide n'est pas une constante ; il est une fonction directe de la pression ambiante. La réduction de cette pression avec un vide diminue l'énergie requise pour que les molécules passent à l'état gazeux, ce qui provoque l'ébullition de la substance à une température considérablement réduite.

La physique de l'ébullition : la pression est la clé
Pour comprendre pourquoi le vide a un effet si puissant, nous devons d'abord redéfinir ce qu'est réellement l'"ébullition". Il s'agit moins d'une température spécifique que d'une bataille de pressions.
Ce que signifie réellement l'ébullition
L'ébullition est l'état physique spécifique où la pression de vapeur d'un liquide devient égale à la pression ambiante de son environnement.
À ce point d'équilibre, des bulles de vapeur peuvent se former à l'intérieur du liquide et remonter à la surface. Ceci est fondamentalement différent de la simple évaporation, qui ne se produit qu'à la surface du liquide.
Le rôle de la pression de vapeur
Chaque liquide exerce une certaine pression de vapeur, qui est la force inhérente de ses molécules essayant de s'échapper dans la phase gazeuse.
Lorsque vous chauffez un liquide, ses molécules gagnent de l'énergie cinétique. Cette énergie accrue les pousse plus fort contre leur environnement, et ainsi, la pression de vapeur augmente avec la température.
Comment la pression ambiante agit comme un "couvercle"
L'atmosphère qui nous entoure exerce une pression constante sur tout, y compris la surface des liquides. Vous pouvez considérer cette pression ambiante comme un "couvercle" physique maintenant les molécules du liquide en place.
Pour qu'un liquide bout, sa pression de vapeur doit devenir suffisamment forte pour "soulever le couvercle". Au niveau de la mer (1 atmosphère de pression), l'eau doit atteindre 100°C (212°F) pour générer suffisamment de pression de vapeur pour y parvenir.
Comment le vide change l'équation
Une pompe à vide fonctionne en retirant les molécules de gaz d'un système scellé, réduisant ainsi considérablement la pression ambiante. Cela modifie fondamentalement les conditions requises pour l'ébullition.
Retirer le "couvercle"
L'application d'un vide équivaut à soulever ce "couvercle" de pression. Avec moins de molécules de gaz poussant sur la surface du liquide, les molécules peuvent s'échapper beaucoup plus facilement.
C'est la même raison pour laquelle l'eau bout à une température plus basse en haute altitude. La pression atmosphérique est plus faible sur une montagne, donc moins de chaleur est nécessaire pour que la pression de vapeur de l'eau l'égale.
Le nouveau point d'ébullition, plus bas
Parce que la pression externe est maintenant beaucoup plus basse, le liquide n'a pas besoin d'autant d'énergie thermique pour augmenter sa pression de vapeur jusqu'au point d'ébullition.
Le résultat est que la substance bouillira à une température bien inférieure à son point d'ébullition standard. Par exemple, sous un vide suffisamment puissant, l'eau peut être amenée à bouillir à température ambiante.
Application pratique : la distillation sous vide
Ce principe est essentiel en chimie pour purifier les composés sensibles à la chaleur. Un chimiste peut placer un mélange sous vide et le chauffer doucement.
Un solvant volatil s'évaporera à une très basse température, laissant derrière lui le composé désiré, plus délicat, qui n'est jamais exposé à une chaleur élevée potentiellement dommageable.
Comprendre les compromis et les pièges
Bien que puissant, l'utilisation du vide pour abaisser le point d'ébullition n'est pas sans défis et nécessite une attention particulière.
Risque de "chocs"
Sous vide, les liquides peuvent bouillir de manière explosive dans un phénomène appelé chocs. Un chauffage inégal peut provoquer une surchauffe d'une partie du liquide, se transformant soudainement en vapeur avec une force violente. Cela est généralement géré en utilisant des billes d'ébullition ou une agitation constante.
Difficulté avec les substances à faible volatilité
Pour les substances ayant des forces intermoléculaires très faibles et donc des pressions de vapeur très basses (comme les huiles ou les liquides ioniques), même un vide poussé peut ne pas abaisser suffisamment le point d'ébullition pour empêcher la décomposition thermique. Il existe une limite pratique à l'utilité de la technique.
Équipement et intégrité du joint
Atteindre et maintenir un vide poussé nécessite des pompes spécialisées et une verrerie ou des récipients parfaitement étanches. Même une fuite mineure peut compromettre la pression du système, entraînant une augmentation inattendue du point d'ébullition.
Faire le bon choix pour votre objectif
La manipulation de la pression est un outil, et son application dépend entièrement de votre objectif.
- Si votre objectif principal est de purifier un composé sensible à la chaleur : Utilisez la distillation sous vide pour séparer les composants à des températures qui empêchent la décomposition ou les réactions secondaires indésirables.
- Si votre objectif principal est d'éliminer efficacement un solvant : Appliquez un vide, souvent avec rotation (comme dans un évaporateur rotatif), pour évaporer rapidement les solvants sans nécessiter de chaleur élevée.
- Si votre objectif principal est de déshydrater un matériau délicat : Utilisez un vide poussé pour abaisser le point d'ébullition/sublimation de l'eau, permettant une déshydratation à basse température (lyophilisation) qui préserve la structure du matériau.
En fin de compte, comprendre la relation entre la pression et la température vous donne un contrôle précis sur l'état physique d'une substance.
Tableau récapitulatif :
| Condition de pression | Effet sur le point d'ébullition | Application clé |
|---|---|---|
| Pression standard (1 atm) | Le point d'ébullition est à sa température standard, élevée. | Processus de distillation standard. |
| Sous vide (pression réduite) | Le point d'ébullition est significativement abaissé. | Purification de composés sensibles à la chaleur, élimination efficace des solvants. |
Besoin d'un contrôle précis de la température pour vos composés sensibles ? KINTEK est spécialisé dans les équipements de distillation et d'évaporation sous vide de haute qualité, y compris les évaporateurs rotatifs, conçus pour protéger vos matériaux délicats en abaissant les points d'ébullition. Nos équipements de laboratoire garantissent un traitement efficace et sûr pour les chercheurs et les professionnels de laboratoire. Contactez nos experts dès aujourd'hui pour trouver la solution de vide parfaite pour votre application !
Guide Visuel
Produits associés
- Pompe à vide à eau en circulation pour usage en laboratoire et industriel
- Pompe à vide rotative à palettes de laboratoire pour usage en laboratoire
- Pompe à vide à membrane sans huile pour usage en laboratoire et industriel
- Presse à chaud sous vide hydraulique chauffée électriquement pour laboratoire
- Robinet à boisseau sphérique à vide en acier inoxydable 304 316, vanne d'arrêt pour systèmes à vide poussé
Les gens demandent aussi
- Quels sont les avantages d'une pompe à vide à circulation d'eau ? Durabilité supérieure pour les environnements de laboratoire exigeants
- Quel est le rôle de la chambre de compression dans une pompe à vide ? Le cœur de la génération de vide
- Pourquoi une pompe à vide à anneau liquide est-elle adaptée à la manipulation de gaz inflammables ou explosifs ? Sécurité intrinsèque grâce à la compression isotherme
- Quelle est l'importance d'une pompe à vide pour les interfaces hybrides de Schottky ? Atteindre une pureté et une liaison au niveau atomique
- Qu'est-ce qui détermine le degré de vide atteignable par une pompe à vide à circulation d'eau ? Découvrez la physique de ses limites



















