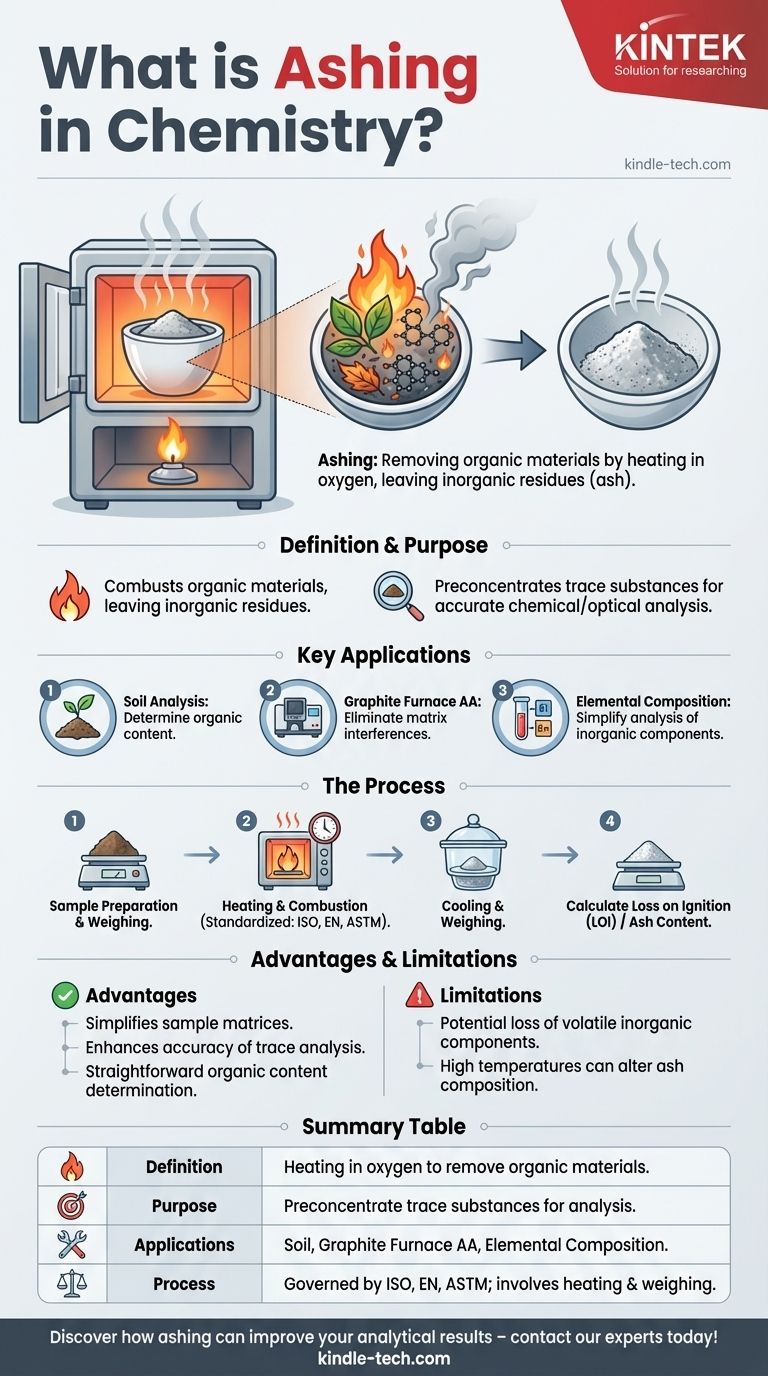
La calcination en chimie est un processus utilisé pour éliminer les matières organiques d'un échantillon en le chauffant en présence d'oxygène, ne laissant que les résidus inorganiques non combustibles appelés cendres. Cette technique est largement utilisée en chimie analytique pour la préconcentration des substances traces, permettant une analyse plus précise des composants inorganiques par des méthodes telles que la chromatographie ou la spectroscopie. La calcination est également employée dans l'analyse des sols pour déterminer la teneur en matières organiques et dans les programmes d'absorption atomique (AA) à four en graphite pour éliminer les interférences de matrice. Le processus est souvent standardisé par des protocoles internationaux tels que l'ISO, l'EN ou l'ASTM, avec des applications incluant les mesures de Perte au Feu (LOI).

Points clés expliqués :
-
Définition et objectif de la calcination :
- La calcination est un processus de minéralisation qui implique de chauffer un échantillon en présence d'oxygène pour combuster les matières organiques, ne laissant que des résidus inorganiques (cendres).
- L'objectif principal est de préconcentrer les substances traces pour une analyse chimique ou optique ultérieure, telle que la chromatographie ou la spectroscopie.
-
Applications de la calcination :
- Analyse des sols : La calcination est utilisée pour déterminer la teneur en matières organiques du sol en comparant la masse avant et après le processus.
- AA à four en graphite : En spectroscopie d'absorption atomique, la calcination élimine les constituants de la matrice qui pourraient interférer avec la mesure de l'analyte.
- Analyse de la composition élémentaire : En éliminant les matières organiques, la calcination simplifie l'analyse des composants inorganiques d'un échantillon.
-
Processus de calcination :
- Les échantillons sont chauffés à l'air jusqu'à combustion, oxydant les composés organiques et laissant derrière eux des résidus inorganiques non combustibles.
- Le processus est souvent régi par des normes internationales (par exemple, ISO, EN, ASTM) pour garantir la cohérence et la précision.
- Des objectifs spécifiques, tels que la Perte au Feu (LOI), impliquent de peser les échantillons avant et après la calcination pour mesurer la réduction de masse.
-
Importance en chimie analytique :
- La calcination est une étape critique dans la préparation des échantillons pour une analyse précise, en particulier lors du traitement de matrices complexes.
- Elle améliore la sensibilité et la précision des techniques analytiques en éliminant les substances interférentes.
-
Standardisation et protocoles :
- Le processus de calcination est souvent standardisé pour assurer la reproductibilité et la fiabilité entre différents laboratoires.
- Les protocoles peuvent spécifier la température, la durée et d'autres paramètres pour obtenir des résultats cohérents.
-
Avantages de la calcination :
- Simplifie les matrices d'échantillons, facilitant l'analyse des composants inorganiques.
- Améliore la précision de l'analyse des oligo-éléments en éliminant les interférences organiques.
- Fournit une méthode simple pour déterminer la teneur en matières organiques dans des matériaux comme le sol.
-
Limites et considérations :
- Le processus peut entraîner la perte de composants inorganiques volatils si le contrôle n'est pas rigoureux.
- Des températures élevées peuvent parfois modifier la composition des cendres, nécessitant une calibration et une validation minutieuses des résultats.
En comprenant les principes et les applications de la calcination, les chimistes et les analystes peuvent utiliser efficacement cette technique pour améliorer la précision et la fiabilité de leurs résultats analytiques.
Tableau récapitulatif :
| Aspect | Détails |
|---|---|
| Définition | Chauffage d'un échantillon dans l'oxygène pour éliminer les matières organiques, ne laissant que les cendres inorganiques. |
| Objectif | Préconcentrer les substances traces pour une analyse chimique ou optique précise. |
| Applications | Analyse des sols, AA à four en graphite, analyse de la composition élémentaire. |
| Processus | Gouverné par les normes ISO, EN ou ASTM ; implique le chauffage et la pesée des échantillons. |
| Avantages | Simplifie les matrices, élimine les interférences et détermine la teneur en matières organiques. |
| Limites | Perte potentielle de composants volatils ; les températures élevées peuvent altérer les cendres. |
Découvrez comment la calcination peut améliorer vos résultats analytiques — contactez nos experts dès aujourd'hui !
Guide Visuel
Produits associés
- Four à moufle de laboratoire 1200℃
- Four à moufle de four à étuve de 1400℃ pour laboratoire
- Four à tube de laboratoire à haute température de 1700℃ avec tube en alumine
- Four à vide graphite pour la graphitisation de matériaux négatifs
- Four de graphitisation sous vide horizontal à haute température de graphite
Les gens demandent aussi
- Quel rôle le four à moufle haute température joue-t-il dans la densification des alliages à haute entropie ? Atteindre la densité maximale.
- Quel rôle joue un four à moufle programmable dans l'étude des performances à haute température des géopolymères ?
- Pourquoi utilisons-nous un four à moufle ? Pour un traitement à haute température pur, précis et sans contaminants
- Quel rôle les fours à haute température jouent-ils dans le durcissement des résines époxy TGDDM et DETDA ? Maximiser l'efficacité de la réticulation
- Quel rôle joue un four de calcination dans la préparation de particules à cœur creux et à enveloppe ? Obtenir des nanostructures parfaites
- Quel est le rôle principal d'un four à moufle dans la synthèse de Mg(Al1-xCrx)2O4 ? Maîtriser la calcination thermique et la pureté de phase
- Quelle est l'application principale des fours de haute précision dans la synthèse à l'état solide de niobates mixtes tels que La1-xYxNbO4 ?
- Quelle est la partie la plus cruciale dans la détermination de la teneur en cendres ? La clé pour des résultats précis et reproductibles



















