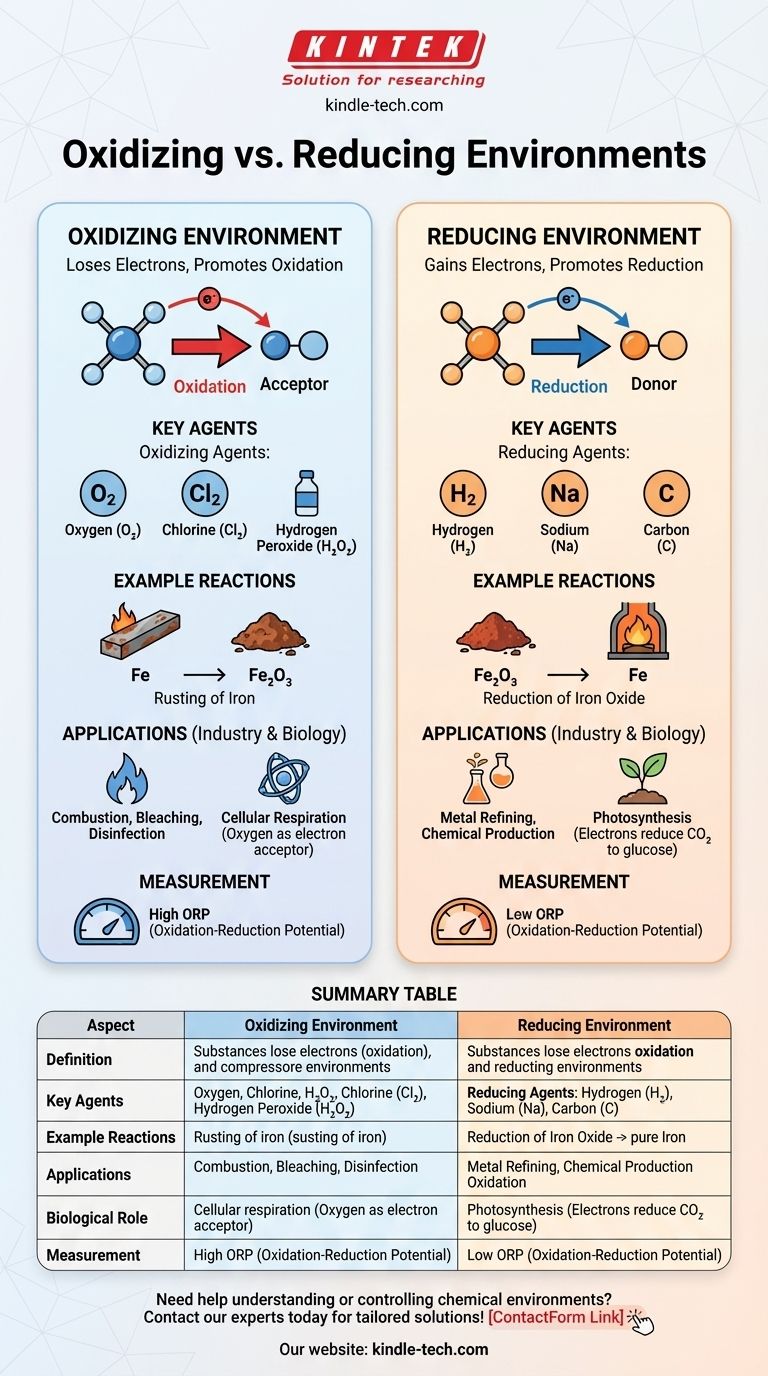
En chimie, un environnement oxydant est un environnement où les substances ont tendance à perdre des électrons, favorisant les réactions d'oxydation, tandis qu'un environnement réducteur est un environnement où les substances ont tendance à gagner des électrons, favorisant les réactions de réduction. La différence clé réside dans la disponibilité des accepteurs d'électrons (agents oxydants) ou des donneurs d'électrons (agents réducteurs). Les environnements oxydants sont caractérisés par la présence d'agents oxydants tels que l'oxygène ou les halogènes, qui facilitent la perte d'électrons. En revanche, les environnements réducteurs contiennent des agents réducteurs tels que l'hydrogène ou les métaux, qui facilitent le gain d'électrons. Ces environnements jouent des rôles essentiels dans les réactions chimiques, les processus industriels et les systèmes biologiques.

Points clés expliqués :
-
Définition des environnements oxydants et réducteurs :
- Environnement oxydant : Un environnement chimique où les substances sont plus susceptibles de perdre des électrons, conduisant à l'oxydation. Cet environnement est riche en agents oxydants, tels que l'oxygène, le chlore ou d'autres accepteurs d'électrons.
- Environnement réducteur : Un environnement chimique où les substances sont plus susceptibles de gagner des électrons, conduisant à la réduction. Cet environnement est riche en agents réducteurs, tels que l'hydrogène, les métaux ou d'autres donneurs d'électrons.
-
Rôle des agents oxydants et réducteurs :
- Agents oxydants : Ce sont des substances qui acceptent des électrons d'autres substances, les oxydant ainsi. Les exemples courants comprennent l'oxygène (O₂), le chlore (Cl₂) et le peroxyde d'hydrogène (H₂O₂).
- Agents réducteurs : Ce sont des substances qui donnent des électrons à d'autres substances, les réduisant ainsi. Les exemples courants comprennent l'hydrogène (H₂), le sodium (Na) et le carbone (C).
-
Réactions chimiques dans différents environnements :
- Environnement oxydant : Dans un tel environnement, les réactions d'oxydation dominent. Par exemple, la rouille du fer se produit dans un environnement oxydant où le fer (Fe) perd des électrons au profit de l'oxygène, formant de l'oxyde de fer (Fe₂O₃).
- Environnement réducteur : Dans un tel environnement, les réactions de réduction dominent. Par exemple, la réduction des oxydes métalliques en métaux purs se produit dans un environnement réducteur, comme lorsque le carbone est utilisé pour réduire l'oxyde de fer en fer dans un haut fourneau.
-
Applications dans l'industrie et la biologie :
- Applications industrielles : Les environnements oxydants sont utilisés dans des processus tels que la combustion, le blanchiment et la désinfection. Les environnements réducteurs sont cruciaux dans des processus tels que l'affinage des métaux et la production de certains produits chimiques.
- Systèmes biologiques : Dans les systèmes biologiques, les environnements oxydants se trouvent dans des processus tels que la respiration cellulaire, où l'oxygène agit comme accepteur final d'électrons. Les environnements réducteurs se trouvent dans des processus tels que la photosynthèse, où les électrons sont donnés pour réduire le dioxyde de carbone en glucose.
-
Mesure et contrôle :
- Potentiel d'oxydo-réduction (ORP) : L'ORP est une mesure de la tendance d'un environnement chimique à gagner ou à perdre des électrons. Un ORP élevé indique un environnement oxydant, tandis qu'un ORP faible indique un environnement réducteur.
- Contrôle dans les processus industriels : Dans les industries, le contrôle de la nature oxydante ou réductrice de l'environnement est crucial pour optimiser les réactions chimiques, garantir la qualité des produits et prévenir les réactions secondaires indésirables.
-
Exemples d'environnements oxydants et réducteurs :
- Environnement oxydant : L'atmosphère terrestre est un environnement oxydant en raison de la présence d'oxygène. C'est pourquoi les métaux comme le fer se corrodent lorsqu'ils sont exposés à l'air.
- Environnement réducteur : L'intérieur d'un haut fourneau est un environnement réducteur où le monoxyde de carbone (CO) agit comme agent réducteur pour convertir le minerai de fer (Fe₂O₃) en fer métallique (Fe).
En comprenant les différences entre les environnements oxydants et réducteurs, les chimistes et les ingénieurs peuvent mieux contrôler et optimiser les réactions chimiques dans diverses applications, des processus industriels aux systèmes biologiques.
Tableau récapitulatif :
| Aspect | Environnement oxydant | Environnement réducteur |
|---|---|---|
| Définition | Les substances perdent des électrons (oxydation) en raison d'accepteurs d'électrons comme l'oxygène ou les halogènes. | Les substances gagnent des électrons (réduction) en raison de donneurs d'électrons comme l'hydrogène ou les métaux. |
| Agents clés | Agents oxydants : Oxygène (O₂), chlore (Cl₂), peroxyde d'hydrogène (H₂O₂). | Agents réducteurs : Hydrogène (H₂), sodium (Na), carbone (C). |
| Exemples de réactions | Rouille du fer (Fe → Fe₂O₃). | Réduction de l'oxyde de fer en fer (Fe₂O₃ → Fe). |
| Applications | Combustion, blanchiment, désinfection. | Affinage des métaux, production chimique. |
| Rôle biologique | Respiration cellulaire (oxygène comme accepteur d'électrons). | Photosynthèse (les électrons réduisent le CO₂ en glucose). |
| Mesure | Potentiel d'oxydo-réduction (ORP) élevé. | Potentiel d'oxydo-réduction (ORP) faible. |
Besoin d'aide pour comprendre ou contrôler les environnements chimiques ? Contactez nos experts dès aujourd'hui pour des solutions sur mesure !
Guide Visuel
Produits associés
- Four à atmosphère d'hydrogène contrôlée à l'azote
- Système d'équipement de machine HFCVD pour le revêtement de nanodiamant de filière de tréfilage
- Équipement de système de chambre de dépôt chimique en phase vapeur de four à tube CVD polyvalent fabriqué sur mesure par le client
- Four de Fusion par Induction sous Vide à l'Échelle du Laboratoire
- Four à vide graphite pour la graphitisation de matériaux négatifs
Les gens demandent aussi
- Pourquoi l'atmosphère d'un four est-elle cruciale ? Facteurs clés pour la qualité et la performance des matériaux
- Pourquoi un four à atmosphère contrôlée est-il essentiel pour la synthèse de TiMoOx ? Protéger les supports en carbone et améliorer les oxydes
- Qu'est-ce que le brasage ? Un guide pour un assemblage solide, polyvalent et esthétique
- Quelle est la fonction d'un environnement d'argon de haute pureté lors de la céramisation in-situ ? Assurer la formation de phases céramiques durcies
- Comment une atmosphère réductrice est-elle utilisée dans les opérations de fonderie ? Guide essentiel de la réduction du minerai de fer et du raffinage des métaux
- Quelles sont les atmosphères pour les fours de traitement thermique ? Un guide pour un contrôle précis de la surface
- Quels sont les types d'atmosphères de four ? Maîtrisez votre processus thermique avec le bon environnement
- Pourquoi l'hydrogène est-il utilisé dans les fours ? Obtenez une pureté supérieure et des finitions brillantes












