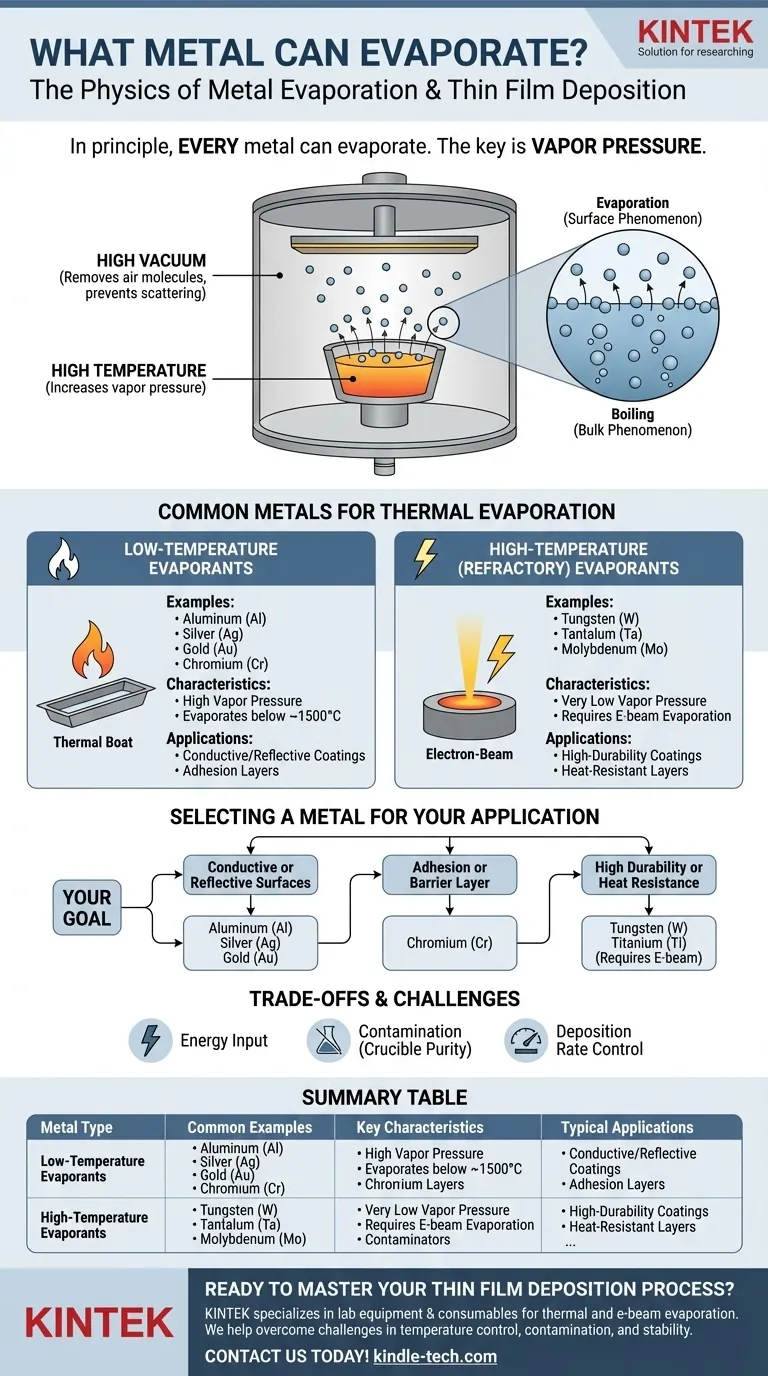
En principe, chaque métal peut s'évaporer. L'évaporation est un processus physique qui se produit lorsqu'un élément ou un composé passe d'une phase liquide ou solide à une phase gazeuse. Pour les métaux, ce processus est régi par la température et la pression, avec des exemples courants dans les applications techniques incluant l'évaporation thermique de l'or (Au), du chrome (Cr) et du germanium (Ge) pour créer des couches minces.
La question fondamentale n'est pas de savoir si un métal peut s'évaporer, mais avec quelle facilité il le fait. Cela est déterminé par la pression de vapeur intrinsèque du métal – une mesure de sa tendance à devenir un gaz à une température donnée. Les métaux ayant une pression de vapeur plus élevée sont beaucoup plus faciles à évaporer.

La physique de l'évaporation des métaux
Pour comprendre quels métaux sont pratiques pour l'évaporation, vous devez d'abord comprendre les principes qui régissent le processus. C'est un équilibre entre les propriétés du matériau et l'environnement que vous créez.
Qu'est-ce que la pression de vapeur ?
La pression de vapeur est la pression exercée par une vapeur en équilibre avec sa phase solide ou liquide. Chaque matériau a une pression de vapeur, et celle-ci augmente significativement avec la température.
Un métal avec une pression de vapeur élevée s'évaporera à un taux beaucoup plus élevé à une température donnée qu'un métal avec une faible pression de vapeur. C'est la propriété la plus importante déterminant son aptitude à l'évaporation.
Le rôle de la température et du vide
Pour atteindre un taux d'évaporation utile pour la plupart des métaux, vous avez besoin de très hautes températures, souvent des centaines ou des milliers de degrés Celsius.
Ce processus est presque toujours effectué dans une chambre à vide poussé. Le vide élimine les molécules d'air, qui autrement entreraient en collision avec les atomes de métal en évaporation, les dispersant et les empêchant d'atteindre leur substrat cible.
Évaporation vs Ébullition
L'évaporation est un phénomène de surface où les atomes individuels acquièrent suffisamment d'énergie pour s'échapper. L'ébullition est un phénomène de masse où la pression de vapeur est égale à la pression atmosphérique ambiante, formant des bulles à l'intérieur du matériau.
Dans le dépôt sous vide, l'objectif est d'atteindre un taux d'évaporation contrôlé, et non de faire bouillir violemment le matériau source.
Métaux courants utilisés dans l'évaporation thermique
Les métaux sont souvent classés en fonction des températures requises pour les évaporer efficacement sous vide.
Évaporants à basse température
Ces métaux ont des pressions de vapeur relativement élevées, ce qui leur permet d'être évaporés à des températures gérables (généralement inférieures à 1500°C). Ils sont largement utilisés pour créer des revêtements.
Les exemples courants incluent l'aluminium (Al), l'argent (Ag), l'or (Au) et le chrome (Cr). Leur facilité d'utilisation en fait des éléments essentiels en électronique et en optique.
Évaporants à haute température (réfractaires)
Les métaux réfractaires ont des pressions de vapeur extrêmement basses et des points de fusion très élevés, ce qui les rend difficiles à évaporer avec des méthodes thermiques simples.
Des métaux comme le tungstène (W), le tantale (Ta) et le molybdène (Mo) nécessitent des techniques spécialisées, telles que l'évaporation par faisceau d'électrons, qui peuvent atteindre les températures localisées beaucoup plus élevées nécessaires.
Comprendre les compromis
Le simple choix d'un métal ne suffit pas ; vous devez comprendre les défis pratiques et les limites du processus d'évaporation.
Le défi des métaux réfractaires
L'évaporation d'un métal comme le tungstène nécessite une immense quantité d'énergie. L'équipement est plus complexe et coûteux, car il doit être capable de générer et de supporter des températures extrêmes sans contaminer le processus.
Pureté de la source et contamination
Le matériau du creuset ou du "bateau" contenant le métal peut également être une source de contamination. À hautes températures, le matériau du bateau lui-même peut s'évaporer ou réagir avec le métal en fusion, introduisant des impuretés dans votre couche mince finale.
Taux de dépôt et contrôle
Le taux d'évaporation d'un métal peut changer considérablement avec de petites fluctuations de température. Le maintien d'un processus de dépôt stable et reproductible nécessite un contrôle de température très précis, ce qui est plus facile pour les matériaux à basse température que pour les métaux réfractaires.
Sélectionner un métal pour votre application
Votre choix de métal doit être entièrement dicté par l'objectif de la couche mince que vous créez.
- Si votre objectif principal est de créer des surfaces conductrices ou réfléchissantes : Des métaux comme l'aluminium (Al), l'argent (Ag) et l'or (Au) sont d'excellents choix en raison de leur conductivité/réflectivité élevée et de leur évaporation relativement facile.
- Si votre objectif principal est une couche d'adhérence ou de barrière : Le chrome (Cr) est un choix standard car il adhère bien à de nombreux substrats comme le verre, ce qui en fait une excellente couche intermédiaire pour les dépôts ultérieurs.
- Si votre objectif principal nécessite une durabilité ou une résistance à la chaleur élevée : Vous devrez utiliser un métal réfractaire comme le tungstène (W) ou le titane (Ti), mais préparez-vous à un processus d'évaporation par faisceau d'électrons plus complexe et plus énergivore.
En fin de compte, la compréhension de la pression de vapeur d'un métal est la clé pour maîtriser son évaporation pour toute application technique.
Tableau récapitulatif :
| Type de métal | Exemples courants | Caractéristiques clés | Applications typiques |
|---|---|---|---|
| Évaporants à basse température | Aluminium (Al), Or (Au), Argent (Ag), Chrome (Cr) | Haute pression de vapeur, s'évapore en dessous de ~1500°C | Revêtements conducteurs, surfaces réfléchissantes, couches d'adhérence |
| Évaporants à haute température (réfractaires) | Tungstène (W), Tantale (Ta), Molybdène (Mo) | Très faible pression de vapeur, nécessite une évaporation par faisceau d'électrons | Revêtements de haute durabilité, couches résistantes à la chaleur |
Prêt à maîtriser votre processus de dépôt de couches minces ?
Le choix du bon métal et de la bonne technique d'évaporation est essentiel pour obtenir des résultats de haute qualité et constants. KINTEK est spécialisé dans les équipements de laboratoire et les consommables pour l'évaporation thermique et par faisceau d'électrons, fournissant les outils précis et le support expert dont vous avez besoin.
Nous aidons nos clients en R&D et en fabrication à surmonter des défis tels que le contrôle de la température, la contamination et la stabilité du taux de dépôt. Contactez-nous dès aujourd'hui pour discuter de votre application spécifique et laissez nos experts vous guider vers la solution optimale pour les besoins de votre laboratoire.
Prenez contact via notre formulaire de contact
Guide Visuel
Produits associés
- Système de chambre de dépôt chimique en phase vapeur CVD Équipement Four tubulaire PECVD avec gazéificateur liquide Machine PECVD
- Four à atmosphère contrôlée de 1400℃ avec atmosphère d'azote et inerte
- Four tubulaire CVD à chambre divisée avec station de vide, équipement de dépôt chimique en phase vapeur
- Système RF PECVD Dépôt chimique en phase vapeur assisté par plasma à radiofréquence RF PECVD
- Four à atmosphère contrôlée 1200℃ Four à atmosphère inerte d'azote
Les gens demandent aussi
- De quelle couleur sont les diamants CVD ? Comprendre le processus, de la teinte brune à la beauté incolore
- Quelles sont les étapes du processus CVD ? Un guide du dépôt de couches minces de précision
- Quels sont les différents types de couches minces ? Un guide sur les revêtements optiques, électriques et fonctionnels
- Comment fonctionne le PECVD ? Permettre le dépôt de couches minces de haute qualité à basse température
- Comment les films minces sont-ils déposés ? Un guide des méthodes PVD vs CVD pour votre application



















