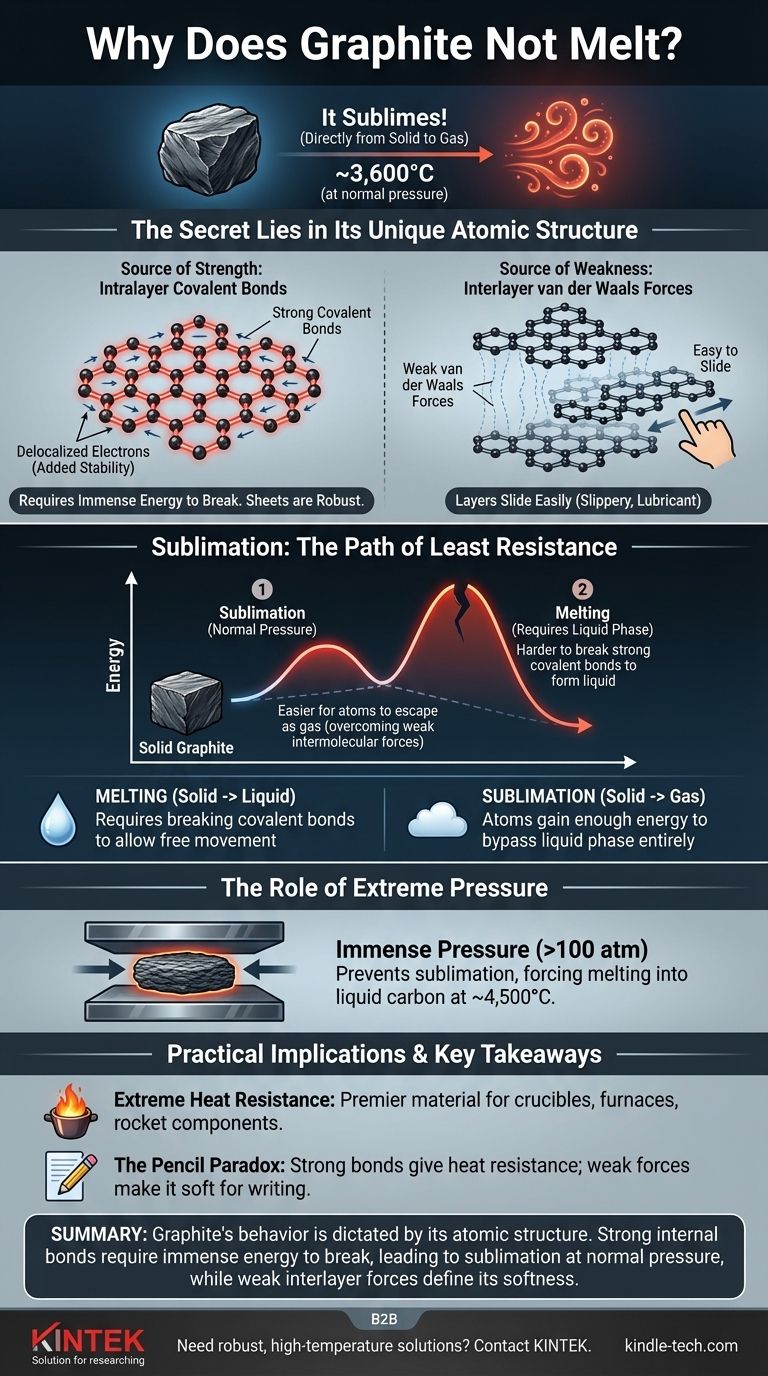
C'est une idée fausse courante que le graphite ne fond pas. À pression atmosphérique normale, le graphite fait quelque chose de différent : il se sublime, passant directement de l'état solide à l'état gazeux à une température incroyablement élevée d'environ 3 600 °C (6 500 °F). Ce comportement est le résultat direct de l'immense force des liaisons chimiques qui maintiennent ses atomes de carbone ensemble.
La raison fondamentale de l'extrême résistance à la chaleur du graphite est sa structure atomique unique. Elle se compose de couches d'atomes de carbone reliées par des liaisons covalentes exceptionnellement fortes, qui nécessitent une énorme quantité d'énergie pour se rompre et permettre à la substance de changer d'état.

Décortiquer la structure atomique du graphite
Pour comprendre pourquoi le graphite se comporte ainsi, nous devons examiner comment ses atomes de carbone sont agencés. Sa structure est définie par deux types de liaisons chimiques très différents agissant simultanément.
La source de la force : les liaisons covalentes au sein des couches
Le graphite est composé de feuilles plates et bidimensionnelles d'atomes de carbone disposés en un réseau hexagonal, semblable à un nid d'abeille.
Au sein de chaque feuille, chaque atome de carbone est lié à trois autres par des liaisons covalentes fortes. Ce sont parmi les liaisons chimiques les plus puissantes de la nature.
De plus, un électron de chaque atome de carbone devient délocalisé, ce qui signifie qu'il est libre de se déplacer sur toute la feuille. Ce partage d'électrons entre tous les atomes de la couche ajoute une stabilité significative et renforce davantage les liaisons, rendant les feuilles incroyablement robustes et difficiles à briser.
La source de la faiblesse : les forces entre les couches
Bien que les atomes au sein d'une couche soient liés puissamment, les couches elles-mêmes sont maintenues ensemble par des forces beaucoup plus faibles appelées forces de van der Waals.
Ces forces sont suffisamment faibles pour que les couches puissent facilement glisser les unes sur les autres. C'est pourquoi le graphite semble glissant et est utilisé comme lubrifiant et dans les crayons — l'écriture laisse des couches de graphite sur le papier.
La sublimation : la voie de moindre résistance
L'extrême différence entre les liaisons fortes à l'intérieur des couches et les forces faibles entre elles dicte la manière dont le graphite réagit à la chaleur.
Fusion contre sublimation
La fusion est le processus par lequel un solide se transforme en liquide. Pour que cela se produise, les atomes doivent gagner suffisamment d'énergie pour se libérer de leurs positions fixes tout en restant attirés les uns par les autres.
La sublimation est la transition directe d'un solide à un gaz. Dans ce cas, les atomes gagnent tellement d'énergie qu'ils contournent complètement la phase liquide et s'échappent dans l'air.
Pourquoi la sublimation l'emporte à pression normale
À pression atmosphérique standard, l'énergie nécessaire pour rompre les puissantes liaisons covalentes au sein des couches de graphite est immense.
Avant que la structure ne puisse absorber suffisamment d'énergie pour fondre en un liquide, les atomes à la surface gagnent suffisamment d'énergie pour vaincre les faibles forces intermoléculaires et s'envoler simplement sous forme de gaz. Il est énergétiquement plus facile pour les atomes de passer directement à l'état gazeux que de rompre les liaisons covalentes nécessaires pour former un liquide.
Le rôle de la pression extrême
Le graphite peut être forcé de fondre, mais seulement dans des conditions extraordinaires.
En appliquant une pression immense (plus de 100 fois la pression atmosphérique normale), vous pouvez empêcher les atomes de carbone de s'échapper sous forme de gaz. Dans ces conditions, le graphite fondra en carbone liquide à une température d'environ 4 500 °C (8 132 °F).
Les implications pratiques de cette structure
Cette structure de double liaison unique confère au graphite un ensemble de propriétés qui semblent contradictoires mais qui sont essentielles pour ses applications industrielles.
Résistance extrême à la chaleur
Le point de sublimation élevé fait du graphite un matériau de premier choix pour les environnements à haute température. Il est utilisé pour fabriquer des creusets pour la fusion des métaux, des revêtements de fours et des composants de moteurs de fusée qui doivent résister à une chaleur énorme.
Le paradoxe du crayon
La structure du graphite explique comment il peut être à la fois incroyablement résistant à la chaleur et étonnamment tendre. La force provient des liaisons covalentes au sein des couches, tandis que la douceur et les propriétés lubrifiantes proviennent de la facilité avec laquelle ces couches glissent les unes sur les autres.
Points clés pour comprendre le graphite
- Si votre objectif principal est son comportement sous l'effet de la chaleur : Rappelez-vous qu'à pression normale, le graphite se sublime directement en gaz car l'énergie nécessaire pour ce faire est inférieure à l'énergie requise pour rompre les liaisons covalentes et former un liquide.
- Si votre objectif principal est ses propriétés physiques : La clé est sa structure en couches. Les liaisons fortes à l'intérieur des couches assurent la résistance à la chaleur, tandis que les forces faibles entre les couches le rendent tendre et un lubrifiant efficace.
- Si votre objectif principal est la définition technique de la fusion : Le graphite peut absolument fondre, mais uniquement sous une pression extrêmement élevée qui empêche les atomes de se sublimer au préalable.
En fin de compte, le comportement du graphite est une illustration parfaite de la façon dont la structure atomique d'un matériau dicte ses propriétés dans le monde réel.
Tableau récapitulatif :
| Propriété | Description | Raison clé |
|---|---|---|
| Point de sublimation | ~3 600 °C (à pression normale) | Les faibles forces de van der Waals entre les couches permettent aux atomes de s'échapper sous forme de gaz avant la fusion. |
| Point de fusion | ~4 500 °C (sous pression extrême > 100 atm) | La haute pression empêche la sublimation, forçant la rupture des liaisons covalentes pour la fusion. |
| Résistance à la chaleur | Excellente pour les applications à haute température | Les liaisons covalentes extrêmement fortes au sein des couches de carbone nécessitent une énergie immense pour se rompre. |
Besoin de solutions robustes et résistantes aux hautes températures pour votre laboratoire ?
Les propriétés uniques du graphite en font un matériau essentiel pour les applications exigeantes. Chez KINTEK, nous nous spécialisons dans la fourniture d'équipements et de consommables de laboratoire de haute qualité, y compris des creusets en graphite et des composants de four, conçus pour résister à des conditions extrêmes.
Laissez nos experts vous aider à choisir les bons matériaux pour améliorer l'efficacité et la sécurité de votre laboratoire. Contactez KINTEK dès aujourd'hui pour discuter de vos besoins spécifiques en matière de haute température !
Guide Visuel
Produits associés
- Four de graphitisation sous vide vertical à haute température
- Four de graphitation sous vide à ultra-haute température au graphite
- Four de graphitisation de film de haute conductivité thermique sous vide de graphite
- Four de graphitation continue sous vide de graphite
- Four à tube de laboratoire à haute température de 1400℃ avec tube en alumine
Les gens demandent aussi
- Qu'est-ce qui rend le graphite si spécial ? Découverte de ses propriétés uniques pour les applications extrêmes
- À quoi sert un four à graphite ? Atteindre des températures extrêmes jusqu'à 3000°C dans un environnement contrôlé
- Quelles sont les propriétés physiques et chimiques du graphite ? Un matériau unique pour les applications extrêmes
- Quelle est la résistance à la température du graphite ? Exploiter son potentiel à haute température dans votre laboratoire
- Le graphite est-il affecté par la chaleur ? Découvrez sa force et sa stabilité remarquables à hautes températures



















