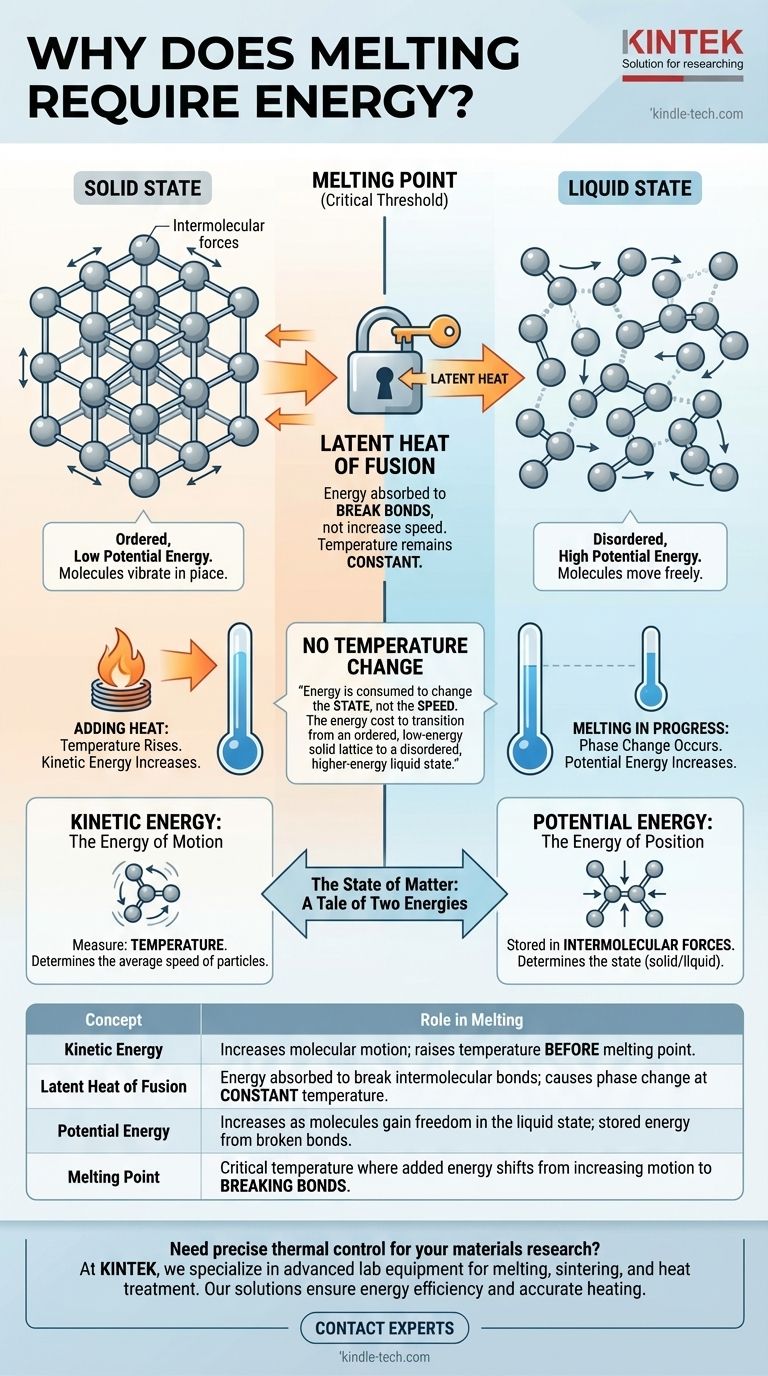
Au niveau moléculaire, la fusion nécessite de l'énergie car cette énergie est utilisée pour rompre les liaisons rigides qui maintiennent les particules ensemble dans une structure solide fixe. Cette énergie, connue sous le nom de chaleur latente, n'augmente pas la vitesse des molécules — et n'augmente donc pas la température — mais augmente plutôt leur énergie potentielle, leur donnant la liberté de se déplacer et de glisser les unes sur les autres en tant que liquide.
La raison fondamentale pour laquelle la fusion nécessite de l'énergie sans changement de température est que l'énergie est consommée pour changer l'état, et non la vitesse, des molécules. C'est le coût énergétique pour passer d'un réseau solide ordonné et de basse énergie à un état liquide désordonné et de plus haute énergie.

L'état de la matière : une histoire de deux énergies
Pour comprendre l'énergie de la fusion, nous devons d'abord distinguer les deux types d'énergie que possèdent les molécules : cinétique et potentielle.
Énergie Cinétique : L'Énergie du Mouvement
L'énergie cinétique est l'énergie du mouvement. Dans une substance, cela se manifeste par la vibration, la rotation et la translation de ses atomes ou molécules constituants.
La température d'une substance est une mesure directe de l'énergie cinétique moyenne de ses particules. Lorsque vous ajoutez de la chaleur et que la substance devient plus chaude, c'est parce que ses molécules se déplacent plus rapidement.
Énergie Potentielle : L'Énergie de la Position
L'énergie potentielle, dans ce contexte, est l'énergie stockée dans les forces entre les molécules, connues sous le nom de forces intermoléculaires. Elle est déterminée par l'arrangement et la séparation de ces particules.
Une structure ordonnée et étroitement liée comme un solide a une faible énergie potentielle. Une structure désordonnée et fluide comme un liquide a une énergie potentielle plus élevée car les molécules sont plus éloignées et moins contraintes.
L'état Solide : Une Structure Hautement Ordonnée
Dans un solide, les particules sont verrouillées dans un motif fixe et répétitif appelé réseau cristallin. Elles sont maintenues en place par de fortes forces intermoléculaires.
Bien qu'elles ne soient pas immobiles, leur énergie cinétique se limite à vibrer sur place. Elles n'ont pas l'énergie nécessaire pour vaincre les forces qui les maintiennent dans cette structure rigide.
Démystifier le Processus de Fusion
Le changement de phase de solide à liquide se produit dans un processus distinct, par étapes, où l'énergie est allouée à une tâche très spécifique.
Ajout de Chaleur : La Première Étape
Lorsque vous commencez à ajouter de la chaleur à un solide (comme de la glace en dessous de son point de fusion), l'énergie est absorbée sous forme d'énergie cinétique. Les particules vibrent de plus en plus intensément au sein du réseau.
Au cours de cette étape, la température du solide augmente régulièrement.
Atteindre le Point de Fusion : Un Seuil Critique
Le point de fusion est la température à laquelle les particules vibrent si vigoureusement qu'elles sont sur le point de se libérer du réseau.
À cette température exacte, un changement fondamental se produit. Toute énergie supplémentaire ajoutée n'augmente plus la vitesse de vibration (énergie cinétique). Au lieu de cela, elle est dirigée entièrement vers la rupture des forces intermoléculaires.
Le Rôle de la Chaleur Latente de Fusion
L'énergie requise pour changer une substance de l'état solide à l'état liquide à son point de fusion est appelée la chaleur latente de fusion. Le mot « latente » signifie caché, car cet apport d'énergie n'entraîne pas de changement de température.
Considérez cela comme l'utilisation d'une clé pour ouvrir une cage. L'énergie ne sert pas à faire courir plus vite l'occupant à l'intérieur de la cage ; elle est utilisée exclusivement pour ouvrir la serrure et lui permettre de sortir.
De l'Ordre au Désordre : L'État Liquide
Lorsque les molécules absorbent suffisamment de chaleur latente, elles se libèrent de leurs positions fixes dans le réseau. La structure rigide s'effondre et la substance devient liquide.
Dans ce nouvel état liquide, les particules ont une énergie potentielle beaucoup plus élevée, mais leur énergie cinétique moyenne (température) est la même que celle du solide dont elles viennent de fondre. Ce n'est qu'après que tout le solide a fondu que l'ajout de chaleur supplémentaire commencera à augmenter l'énergie cinétique et donc la température du liquide.
Comprendre la Distinction Clé : Chaleur vs. Température
Le concept de chaleur latente résout un point de confusion courant. Il met en évidence la différence entre ajouter de l'énergie et observer une augmentation de la température.
L'Idée Reçue Courante
Beaucoup de gens se demandent : "Si je continue d'ajouter de la chaleur à la glace qui fond, pourquoi la température reste-t-elle à 0°C (32°F) ?"
La réponse est que l'énergie a un travail différent à accomplir pendant un changement de phase. Sa priorité est de rompre les liaisons, et non d'augmenter la vitesse.
La Chaleur est un Transfert d'Énergie, la Température est une Mesure
La chaleur est le transfert d'énergie thermique. La température est une mesure de l'énergie cinétique moyenne.
Pendant la fusion, vous transférez continuellement de la chaleur dans le système, mais cette énergie est convertie en énergie potentielle, laissant l'énergie cinétique moyenne — et donc la température — inchangée.
Comment Appliquer ce Principe
Comprendre ce concept est fondamental pour de nombreuses applications du monde réel et domaines scientifiques.
- Si votre objectif principal est l'observation quotidienne (comme un glaçon dans une boisson) : L'énergie absorbée par le liquide plus chaud est utilisée comme chaleur latente pour rompre les liaisons moléculaires de la glace, ce qui explique pourquoi la boisson refroidit tandis que la glace fond à une température constante.
- Si votre objectif principal est l'ingénierie ou la science des matériaux : La chaleur latente de fusion spécifique est une propriété critique qui détermine le coût énergétique pour faire fondre les métaux ou d'autres matériaux, ce qui a un impact direct sur la conception des fours, la consommation d'énergie et l'efficacité des processus.
- Si votre objectif principal est la chimie ou la physique : Rappelez-vous que les changements de phase représentent un changement d'énergie potentielle (dû aux changements dans les forces intermoléculaires), tandis que les changements de température représentent un changement d'énergie cinétique (dû aux changements dans le mouvement moléculaire).
Saisir le rôle de la chaleur latente est la clé pour comprendre comment l'énergie provoque des changements dans l'état physique de toute matière.
Tableau Récapitulatif :
| Concept | Rôle dans la Fusion |
|---|---|
| Énergie Cinétique | Augmente le mouvement moléculaire ; augmente la température avant le point de fusion. |
| Chaleur Latente de Fusion | Énergie absorbée pour rompre les liaisons intermoléculaires ; provoque un changement de phase à température constante. |
| Énergie Potentielle | Augmente lorsque les molécules gagnent en liberté à l'état liquide ; énergie stockée par les liaisons rompues. |
| Point de Fusion | Température critique où l'énergie ajoutée passe de l'augmentation du mouvement à la rupture des liaisons. |
Besoin d'un contrôle thermique précis pour vos recherches sur les matériaux ? Chez KINTEK, nous sommes spécialisés dans les équipements de laboratoire avancés qui offrent une gestion précise du chauffage et de la température pour des processus tels que la fusion, le frittage et le traitement thermique. Que vous travailliez avec des métaux, des céramiques ou d'autres matériaux, nos solutions garantissent l'efficacité énergétique et des résultats reproductibles. Contactez nos experts dès aujourd'hui pour trouver le four ou le système de chauffage parfait pour les besoins de votre laboratoire.
Guide Visuel
Produits associés
- Four à moufle de laboratoire à moufle à levage par le bas
- Four à moufle de 1800℃ pour laboratoire
- Four à moufle de four à étuve de 1400℃ pour laboratoire
- Four à moufle de 1700℃ pour laboratoire
- Four à tube de laboratoire à haute température de 1400℃ avec tube en alumine
Les gens demandent aussi
- Peut-on réchauffer un joint brasure ? Un guide sur la réparation, le démontage et les processus post-brasage
- Quel rôle jouent les étuves de laboratoire dans la pyrolyse de la bagasse de canne à sucre ? Améliorer la qualité du bio-huile et le PCI
- À quoi peuvent servir les diamants synthétiques ? Alimenter les industries, de l'usinage à l'informatique quantique
- Quels sont les inconvénients du revêtement au graphène ? Coût élevé, application difficile et marketing trompeur
- Quels sont les composants de base d'un spectromètre IR ? Un guide des éléments essentiels des instruments FTIR
- Quel est le processus de frittage des poudres ? Un guide complet pour la fabrication de pièces métalliques et céramiques
- Qu'est-ce qu'une étuve de laboratoire à usage général ? Un guide sur le séchage, la stérilisation et le durcissement
- À quelle température le THC s'évapore-t-il sous vide ? Maîtriser le processus de distillation



















