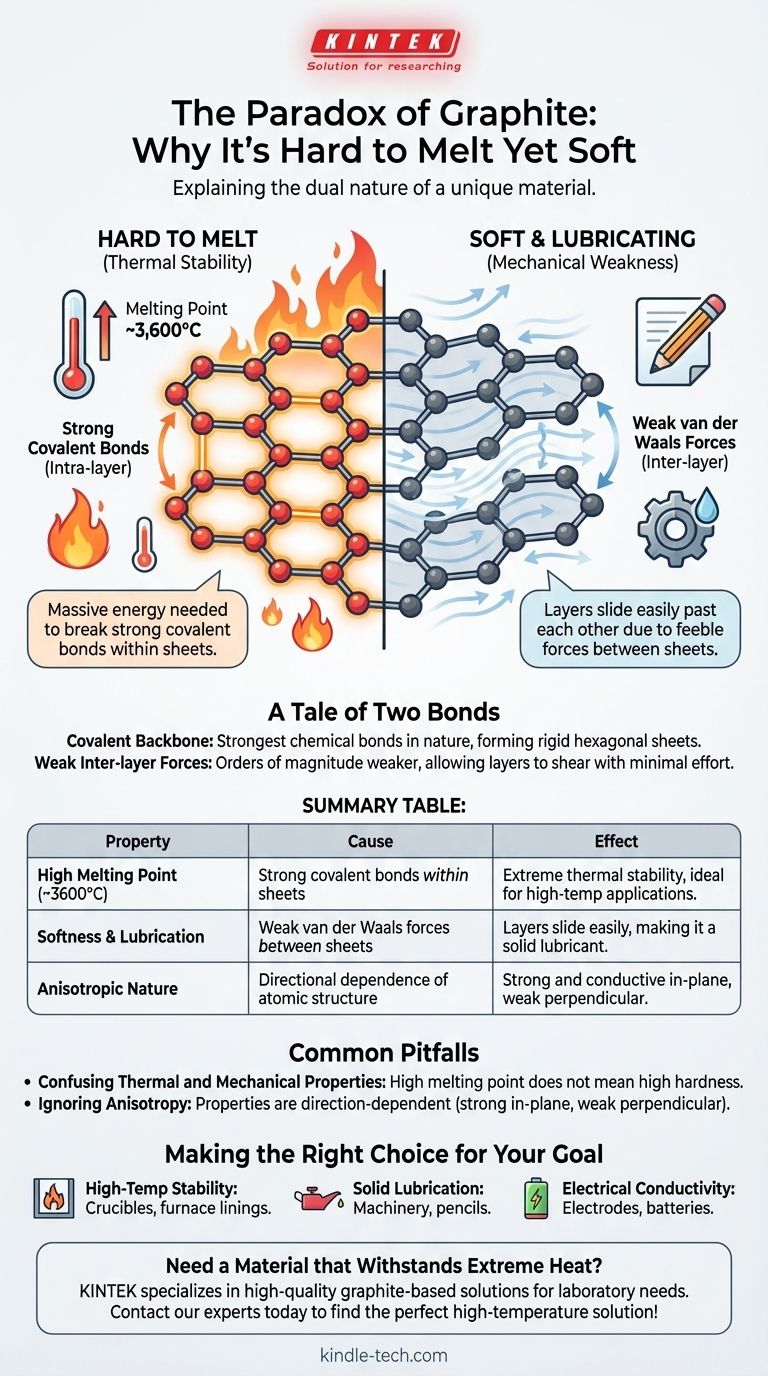
Le paradoxe du graphite réside dans sa double nature : c'est l'un des matériaux les plus tendres connus, mais il possède l'un des points de fusion les plus élevés. Ce comportement découle de sa structure atomique unique, où les atomes de carbone sont maintenus par des liaisons covalentes extrêmement fortes au sein de feuillets plats, nécessitant une quantité massive d'énergie pour briser et faire fondre la substance.
Les propriétés du graphite sont une histoire de deux forces. La force extrême des liaisons covalentes à l'intérieur de ses couches atomiques dicte son point de fusion élevé, tandis que la faiblesse profonde des forces entre ces couches explique pourquoi il semble tendre et agit comme lubrifiant.

Une histoire de deux liaisons : la source de la force du graphite
La résistance du graphite à la fusion est enracinée dans la manière fondamentale dont ses atomes de carbone sont connectés. Cette architecture interne est incroyablement robuste.
L'épine dorsale covalente
Chaque atome de carbone dans une couche de graphite est lié à trois autres par des liaisons covalentes. Ces liaisons, qui impliquent le partage d'électrons entre les atomes, comptent parmi les types de liaisons chimiques les plus fortes dans la nature.
Pour faire fondre une substance, vous devez fournir suffisamment d'énergie thermique pour briser les liaisons qui maintiennent ses atomes dans une structure solide et fixe. Parce que les liaisons covalentes du graphite sont si fortes, l'énergie nécessaire pour les perturber est immense, ce qui entraîne un point de fusion d'environ 3 600 °C (6 500 °F).
Les feuillets hexagonaux
Ces atomes liés par covalence forment de vastes feuillets plats disposés selon un réseau hexagonal, semblable à un nid d'abeille. Vous pouvez considérer chaque feuillet comme une seule couche du matériau merveilleux qu'est le graphène.
À l'intérieur de ces feuillets, la structure est rigide et exceptionnellement stable. La force n'est pas seulement dans une direction ; elle est distribuée sur l'ensemble du plan bidimensionnel.
Résoudre le paradoxe : pourquoi est-il aussi tendre ?
L'explication de la tendreté du graphite se trouve non pas à l'intérieur de ses feuillets atomiques solides, mais dans l'espace entre eux.
Faibles forces inter-couches
Alors que les atomes à l'intérieur d'un feuillet sont puissamment liés, les feuillets eux-mêmes sont empilés les uns sur les autres avec très peu de choses les maintenant ensemble. Ils ne sont attirés que par de faibles forces intermoléculaires connues sous le nom de forces de van der Waals.
Ces forces sont des ordres de grandeur plus faibles que les liaisons covalentes à l'intérieur des feuillets.
Le glissement des couches
Étant donné que l'attraction entre les couches est si faible, les feuillets peuvent facilement glisser les uns sur les autres avec un minimum d'effort. Cette action de glissement est ce que nous percevons comme de la tendreté et ce qui fait du graphite un excellent lubrifiant solide.
Lorsque vous écrivez avec un crayon, vous ne faites que cisailler des milliers de ces couches faiblement liées et les déposer sur le papier.
Intra-couche contre Inter-couche
Cette distinction est la clé pour comprendre le graphite. Les forces intra-couche (liaisons covalentes) sont incroyablement fortes, conférant au graphite sa stabilité thermique. Les forces inter-couches (van der Waals) sont incroyablement faibles, lui conférant sa douceur mécanique.
Pièges courants à éviter
Comprendre le graphite signifie éviter la simplification courante selon laquelle un matériau est soit « dur », soit « mou ». Ses propriétés dépendent fortement du contexte et de la direction.
Confondre les propriétés thermiques et mécaniques
C'est une erreur courante de supposer qu'un point de fusion élevé doit être corrélé à une dureté mécanique élevée. Le graphite est le contre-exemple classique.
Sa stabilité thermique (résistance à la fusion) est régie par ses fortes liaisons covalentes. Ses propriétés mécaniques (tendreté et résistance au cisaillement) sont régies par ses faibles forces inter-couches.
Ignorer l'anisotropie
Le graphite est un matériau hautement anisotrope, ce qui signifie que ses propriétés dépendent de la direction.
Il est extrêmement solide et conduit bien la chaleur et l'électricité dans le plan de ses feuillets atomiques. Cependant, il est mécaniquement faible et mauvais conducteur perpendiculairement à ces feuillets.
Faire le bon choix pour votre objectif
Cette double nature fait du graphite un matériau extraordinairement polyvalent, mais son application doit être alignée sur ses propriétés directionnelles spécifiques.
- Si votre objectif principal est la stabilité à haute température : Le graphite est un excellent choix pour des applications telles que les creusets ou les revêtements de fours car ses fortes liaisons covalentes résistent à la décomposition thermique.
- Si votre objectif principal est la lubrification solide : Les couches coulissantes faiblement liées du graphite le rendent idéal pour réduire la friction dans les machines, les serrures, ou comme « mine » dans les crayons.
- Si votre objectif principal est la conductivité électrique : La structure permet aux électrons de se déplacer librement le long des feuillets, faisant du graphite un matériau utile pour les électrodes, les batteries et les balais dans les moteurs électriques.
Reconnaître que les propriétés macroscopiques d'un matériau sont le résultat direct de sa structure atomique est la clé pour résoudre tout défi d'ingénierie.
Tableau récapitulatif :
| Propriété | Cause | Effet |
|---|---|---|
| Point de fusion élevé (~3600°C) | Fortes liaisons covalentes à l'intérieur des feuillets atomiques | Stabilité thermique extrême, idéal pour les applications à haute température |
| Tendreté et lubrification | Faibles forces de van der Waals entre les feuillets | Les couches glissent facilement, ce qui en fait un lubrifiant solide |
| Nature anisotrope | Dépendance directionnelle de la structure atomique | Solide et conducteur dans le plan, faible perpendiculairement à celui-ci |
Besoin d'un matériau capable de résister à des températures extrêmes ?
Les propriétés uniques du graphite en font un choix idéal pour les fours à haute température, les creusets et autres équipements de laboratoire exigeants. Chez KINTEK, nous nous spécialisons dans la fourniture d'équipements et de consommables de laboratoire de haute qualité, y compris des solutions à base de graphite, pour répondre à vos besoins spécifiques en laboratoire.
Contactez nos experts dès aujourd'hui pour trouver la solution haute température parfaite pour votre application !
Guide Visuel
Produits associés
- Four de graphitation sous vide à ultra-haute température au graphite
- Four de graphitisation sous vide vertical à haute température
- Four de graphitation continue sous vide de graphite
- Four de graphitisation de film de haute conductivité thermique sous vide de graphite
- Four à tube de laboratoire à haute température de 1400℃ avec tube en alumine
Les gens demandent aussi
- Quelle est la principale source de biochar ? Libérez le pouvoir des matières premières durables
- Quels sont les paramètres contrôlables essentiels dans un processus de traitement thermique ? Température de maîtrise, Temps, Atmosphère et Refroidissement
- Quels sont les 3 facteurs qui affectent le taux de transfert de chaleur par conduction ? Maîtrisez le contrôle thermique de votre équipement de laboratoire
- Quel est l'usage du carburant de pyrolyse ? Un substitut durable pour le chauffage et la production d'électricité industriels
- Pourquoi est-il nécessaire d'utiliser un désintégrateur de cellules à ultrasons avant la cytométrie en flux sur levures ? Assurer l'exactitude des données
- Qu'est-ce que la méthode de pulvérisation physique ? Un guide pour le dépôt de couches minces haute performance
- Quel est le but du dépôt par pulvérisation cathodique ? Atteindre une précision et une uniformité à l'échelle atomique
- Quels sont les principes de base d'un four à arc électrique ? Un guide pour un recyclage efficace des métaux



















