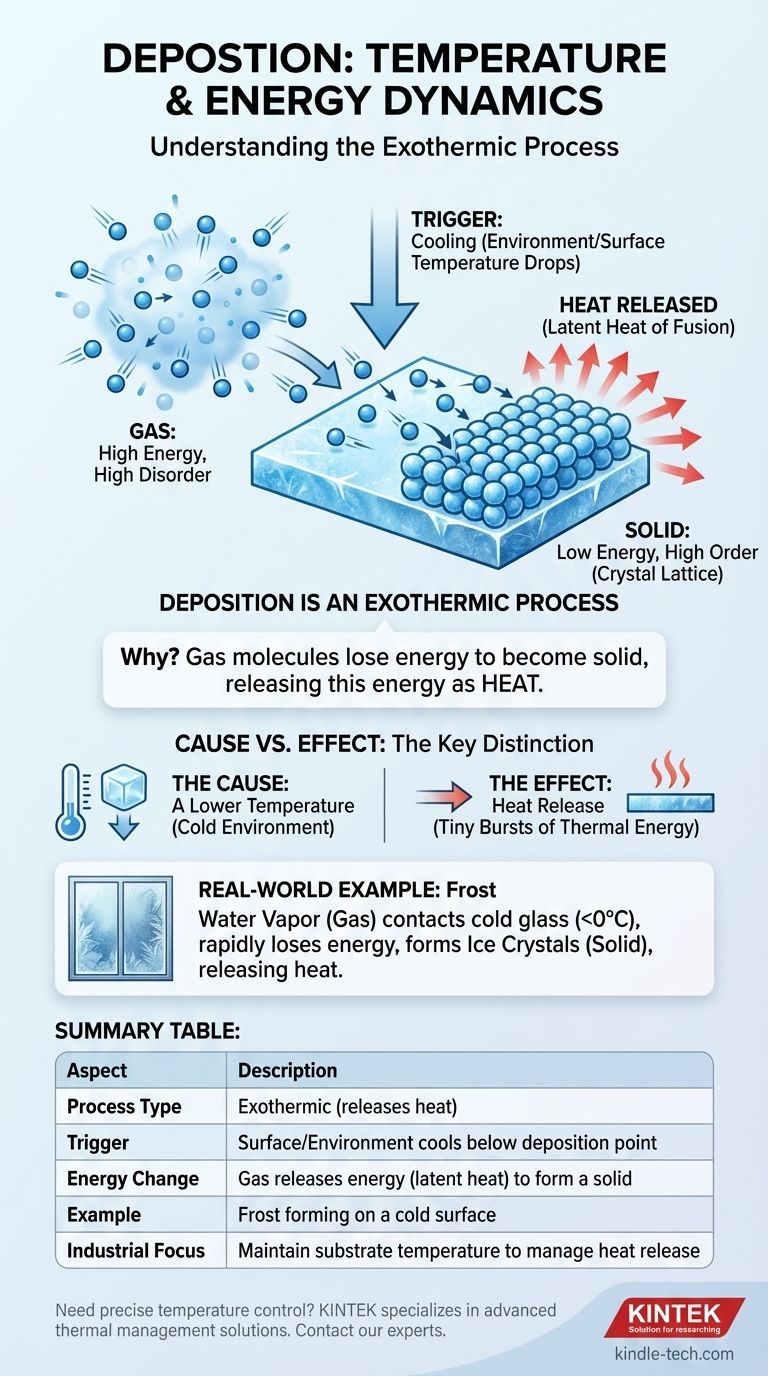
Lors de la transition de phase de la déposition, l'énergie est libérée sous forme de chaleur, ce qui en fait un processus exothermique. Cependant, pour que la déposition se produise, la température d'une surface ou de l'environnement ambiant doit d'abord descendre en dessous du point de déposition de la substance, qui est la température à laquelle elle passe directement d'un gaz à un solide.
La déposition se produit à cause du refroidissement, mais le processus lui-même libère de la chaleur. La substance doit céder de l'énergie pour passer d'un gaz à haute énergie à un solide à basse énergie, et cette énergie cédée est libérée sous forme de chaleur dans l'environnement.

Le principe fondamental : Énergie et états de la matière
Pour comprendre la dynamique de la température de la déposition, vous devez d'abord saisir les niveaux d'énergie des différents états de la matière. La transition entre ces états est entièrement une question de gestion de l'énergie.
Gaz : Haute énergie, grand désordre
Les particules de gaz possèdent une énergie cinétique élevée. Elles se déplacent rapidement et de manière aléatoire, restant éloignées les unes des autres avec de faibles forces intermoléculaires.
Solide : Basse énergie, grand ordre
Dans un solide, les particules sont enfermées dans une structure fixe et ordonnée appelée réseau cristallin. Elles ont une énergie cinétique beaucoup plus faible, vibrant principalement sur place, et sont maintenues ensemble par de fortes liaisons intermoléculaires.
Le pont énergétique : La déposition
La déposition est le processus de passage d'un gaz à haute énergie à un solide à basse énergie. Pour qu'une particule effectue cette transition, elle doit se débarrasser de son excès d'énergie cinétique.
La déposition en tant que processus exothermique
La libération d'énergie définit la nature thermique de la déposition. Il s'agit fondamentalement d'un processus exothermique.
Pourquoi la déposition libère de la chaleur
Lorsque les molécules de gaz se déposent sur une surface et forment des liaisons pour créer un réseau solide, elles passent à un état plus stable et de plus faible énergie. La différence d'énergie entre la phase gazeuse chaotique et la phase solide ordonnée doit être libérée. Cette énergie libérée est connue sous le nom de chaleur latente de fusion et est dégagée dans l'environnement.
Un exemple concret : Le givre
La formation de givre sur une fenêtre froide est un exemple parfait de déposition. La vapeur d'eau (un gaz dans l'air) entre en contact avec une vitre qui est en dessous du point de congélation (0°C ou 32°F). Le verre froid force les molécules de vapeur d'eau à perdre rapidement de l'énergie, les faisant se transformer directement en cristaux de glace (un solide) sans jamais devenir de l'eau liquide.
Comprendre la distinction clé : Cause vs. Effet
Le cœur de la confusion autour de ce sujet est l'incapacité à distinguer la condition requise pour la déposition et le résultat du processus lui-même.
La cause : Une température plus basse
La déposition ne se produit pas spontanément. Elle est déclenchée par le refroidissement. Une substance ne se déposera sur une surface ou dans un environnement qu'à ou en dessous de sa température de déposition. Cet environnement froid agit comme un puits d'énergie, aspirant la chaleur des molécules de gaz.
L'effet : Libération de chaleur
Lorsque les molécules de gaz perdent leur énergie et s'enferment dans une structure solide, cette énergie est libérée sous forme de chaleur. Si vous pouviez le mesurer précisément, la formation d'un cristal de glace sur une surface libère une minuscule bouffée d'énergie thermique.
Le résultat net
Pour que la déposition se poursuive, l'environnement ambiant doit être efficace pour absorber la chaleur latente libérée. Si la chaleur libérée devait réchauffer la surface au-dessus du point de déposition, le processus s'arrêterait ou même s'inverserait en sublimation (solide vers gaz).
Faire le bon choix pour votre objectif
Comprendre ce principe clarifie la manière de penser et de contrôler les transitions de phase.
- Si votre objectif principal est un examen scientifique : N'oubliez pas que la déposition est un processus exothermique où la chaleur est libérée, ce qui en fait l'exact opposé de la sublimation, qui est endothermique.
- Si votre objectif principal est une application industrielle comme le dépôt physique en phase vapeur (PVD) : Votre variable clé est de maintenir le substrat à une température suffisamment basse pour à la fois initier la déposition et évacuer continuellement la chaleur latente libérée par le matériau de revêtement.
- Si votre objectif principal est un modèle mental simple : Pensez au givre se formant sur un pare-brise de voiture pendant la nuit. Le pare-brise doit d'abord devenir froid (la cause), et le processus de formation du givre à sa surface libère une petite quantité de chaleur (l'effet).
En séparant le déclencheur (refroidissement) du processus (libération de chaleur), vous pouvez décrire avec précision la thermodynamique de tout changement de phase.
Tableau récapitulatif :
| Aspect | Description |
|---|---|
| Type de processus | Exothermique (libère de la chaleur) |
| Déclencheur | La surface/l'environnement se refroidit en dessous du point de déposition |
| Changement d'énergie | Le gaz libère de l'énergie (chaleur latente) pour former un solide |
| Exemple | Formation de givre sur une surface froide |
| Focus industriel | Maintenir la température du substrat pour gérer la libération de chaleur |
Besoin d'un contrôle précis de la température pour vos processus de déposition ? KINTEK est spécialisé dans les équipements de laboratoire avancés pour la gestion thermique et les applications de changement de phase. Nos solutions vous aident à maintenir les températures critiques du substrat requises pour une déposition efficace et constante. Contactez nos experts dès aujourd'hui pour optimiser les capacités de votre laboratoire !
Guide Visuel
Produits associés
- Four tubulaire CVD à chambre divisée avec station de vide, équipement de dépôt chimique en phase vapeur
- Four à atmosphère contrôlée 1200℃ Four à atmosphère inerte d'azote
- Four à atmosphère contrôlée de 1400℃ avec atmosphère d'azote et inerte
- Four à atmosphère contrôlée 1700℃ Four à atmosphère inerte d'azote
- Four de graphitation continue sous vide de graphite
Les gens demandent aussi
- Quel est le principe du dépôt chimique en phase vapeur ? Libérez la puissance du dépôt de couches minces de haute pureté
- Qu'est-ce que le processus de pulvérisation cathodique en physique ? Un guide pour le dépôt de films minces de précision
- Quelle méthode parmi les suivantes est utilisée pour créer un film mince ? Un guide sur le PVD par rapport au CVD
- Comment le plasma est-il formé dans la pulvérisation cathodique ? La première étape essentielle pour un dépôt de couche mince précis
- Qu'est-ce que la méthode CVD pour le graphène ? Un processus évolutif pour des films de haute qualité et de grande surface
- Quelles sont les étapes du processus CVD ? Un guide pour maîtriser le dépôt chimique en phase vapeur
- Qu'est-ce que la méthode de dépôt en phase vapeur ? Un guide des technologies de revêtement PVD et CVD
- Qu'est-ce que le dépôt chimique en phase vapeur (CVD) ? Maîtrisez la fabrication de couches minces de haute pureté et de semi-conducteurs



















