En spectroscopie infrarouge (IR), la concentration régit directement l'intensité des bandes d'absorption. Une concentration plus élevée d'un analyte dans un échantillon entraîne une plus grande absorption du rayonnement IR à ses fréquences caractéristiques. Cela provoque l'augmentation de la hauteur et de la proéminence des pics correspondants dans le spectre IR, une relation décrite mathématiquement par la loi de Beer-Lambert.
La relation entre la concentration et l'absorbance IR est puissante pour l'analyse quantitative, mais elle n'est pas parfaitement linéaire dans toutes les situations. Comprendre ses limitations pratiques, telles que la saturation du détecteur à des concentrations élevées et les effets intermoléculaires, est crucial pour une interprétation et une mesure spectrales précises.
Le principe fondamental : la loi de Beer-Lambert
Le lien entre la concentration et l'absorbance est la pierre angulaire de la spectroscopie quantitative. Il fournit un modèle prédictif de la manière dont la lumière interagit avec la matière.
Définition de l'équation (A = εbc)
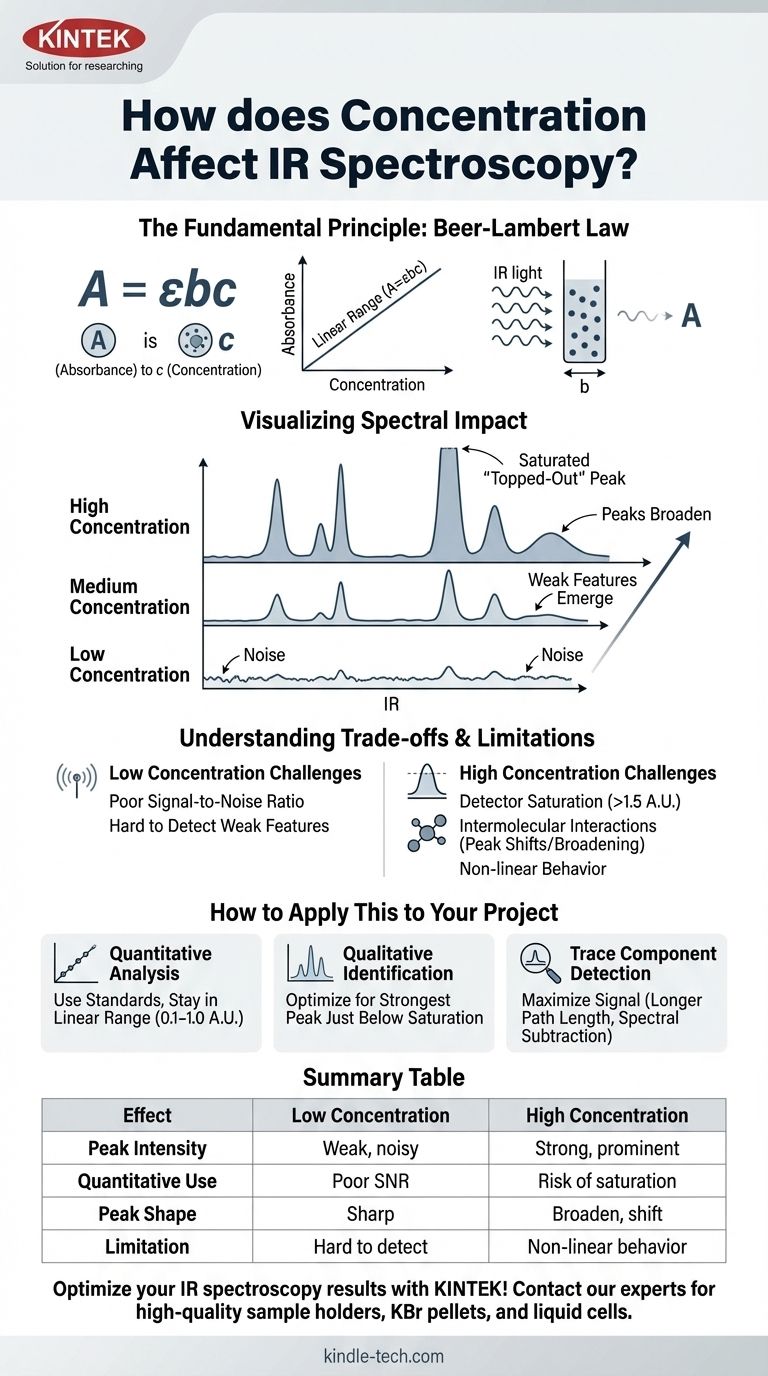
La loi de Beer-Lambert est exprimée par A = εbc.
- A est l'Absorbance (sans unité).
- ε (epsilon) est l'absorptivité molaire, une propriété intrinsèque de la molécule à une longueur d'onde spécifique.
- b est la longueur du trajet de la cuve d'échantillon (par exemple, l'épaisseur d'une cellule liquide), généralement en cm.
- c est la concentration de l'analyte.
Cette équation montre que l'absorbance est directement proportionnelle à la concentration lorsque la longueur du trajet et l'absorptivité molaire sont constantes.
Absorbance vs. Transmittance
Les instruments IR mesurent physiquement la Transmittance (%T), qui est la fraction de lumière qui traverse l'échantillon. Cependant, les analystes travaillent presque toujours avec l'Absorbance (A).
Les deux sont liés par la formule A = -log(T). Le tracé de l'absorbance en fonction de la concentration donne une ligne droite, ce qui est bien plus utile pour l'analyse que la courbe exponentielle produite par la transmittance.
Visualisation de l'impact spectral
Lorsque vous augmentez la concentration d'une substance :
- Les pics deviennent plus hauts : Les valeurs d'absorbance pour tous les pics augmentent.
- Des caractéristiques faibles émergent : De petits pics qui étaient perdus dans le bruit de fond à de faibles concentrations deviennent visibles.
- Les pics intenses s'élargissent : Les bandes d'absorption très intenses ne feront pas que s'élever, elles s'élargiront également.
Comprendre les compromis et les limitations
La loi de Beer-Lambert décrit un scénario idéal. En pratique, plusieurs facteurs peuvent entraîner des déviations par rapport à cette relation linéaire, en particulier à des concentrations élevées.
Le problème des pics "saturés"
Lorsque la concentration est trop élevée, un pic peut devenir si intense qu'il absorbe presque toute la lumière à cette fréquence. L'absorbance peut dépasser la plage optimale du détecteur (généralement > 1,5 U.A.).
Cela fait apparaître le pic aplatit ou "écrêté" au sommet. Toutes les informations quantitatives de ce pic saturé sont perdues, car l'instrument ne peut plus mesurer avec précision la véritable absorbance.
Interactions intermoléculaires
À des concentrations élevées, les molécules sont plus proches les unes des autres et peuvent interagir. Un exemple classique est la liaison hydrogène dans les alcools ou les acides carboxyliques.
Ces interactions peuvent modifier l'énergie vibrationnelle des liaisons, provoquant un déplacement de position, un changement de forme ou un élargissement des pics. Cela modifie l'absorptivité molaire (ε), rompant la relation linéaire simple entre l'absorbance et la concentration.
Effets instrumentaux
Aucun instrument n'est parfait. Une petite quantité de lumière parasite peut atteindre le détecteur sans traverser l'échantillon. Cela entraîne un plateau des lectures d'absorbance à des concentrations élevées, conduisant à une courbe qui se courbe vers l'axe des x au lieu de rester linéaire.
Le défi des faibles concentrations
Inversement, si un échantillon est trop dilué, l'absorbance peut être trop faible pour être distinguée du bruit de fond instrumental. Le faible rapport signal/bruit rend l'identification qualitative et la mesure quantitative peu fiables.
Comment appliquer cela à votre projet
Votre approche de la concentration de l'échantillon dépend entièrement de votre objectif analytique. Vous devez préparer votre échantillon d'une manière qui optimise le spectre pour votre objectif spécifique.
- Si votre objectif principal est l'analyse quantitative : Préparez une série d'étalons et créez une courbe d'étalonnage, en vous assurant que l'absorbance de votre échantillon inconnu se situe dans la plage linéaire de votre courbe (généralement 0,1 à 1,0 U.A.).
- Si votre objectif principal est l'identification qualitative : Ajustez la préparation de votre échantillon (par exemple, la quantité dans une pastille de KBr, la longueur du trajet d'une cellule liquide) pour obtenir un spectre où le pic le plus intense est juste en dessous de la saturation, garantissant que les bandes de groupes fonctionnels plus faibles sont clairement visibles.
- Si votre objectif principal est de détecter un composant à l'état de trace : Utilisez des techniques qui maximisent le signal de l'analyte, telles que l'utilisation de cellules à plus longue longueur de trajet ou l'exécution d'une soustraction spectrale pour éliminer les interférences d'un solvant ou d'une matrice.
En fin de compte, le contrôle et la compréhension de la concentration sont la clé pour transformer un spectre IR d'une simple empreinte digitale en un outil analytique précis.
Tableau récapitulatif :
| Effet de la concentration | Faible concentration | Forte concentration |
|---|---|---|
| Intensité du pic | Pics faibles, bruyants | Pics intenses, proéminents |
| Utilisation quantitative | Faible rapport signal/bruit | Risque de saturation du détecteur |
| Forme du pic | Nette, bien définie | Peut s'élargir et se décaler |
| Limitation clé | Difficile à détecter | Comportement non linéaire de Beer-Lambert |
Optimisez vos résultats de spectroscopie IR avec KINTEK !
Que vous effectuiez une analyse quantitative précise ou que vous ayez besoin d'une identification qualitative fiable, une préparation d'échantillon appropriée est essentielle. KINTEK est spécialisé dans les équipements et consommables de laboratoire de haute qualité, y compris les porte-échantillons IR, les pastilles de KBr et les cellules liquides conçus pour vous aider à atteindre une concentration et une longueur de trajet optimales pour des spectres clairs et précis.
Contactez nos experts dès aujourd'hui pour discuter de vos besoins spécifiques en laboratoire et découvrir comment nos solutions peuvent améliorer votre flux de travail en spectroscopie et la fiabilité de vos données.
Guide Visuel
Produits associés
- Dioxyde d'iridium IrO2 pour l'électrolyse de l'eau
- Lentille en silicium monocristallin à haute résistance infrarouge
- Four de Graphitization Expérimental à Vide de Graphite IGBT
- Substrat de fenêtre en saphir avec revêtement de transmission infrarouge
- Substrat de verre de fenêtre optique, plaquettes, sulfure de zinc ZnS
Les gens demandent aussi
- Quelles sont les limites de la spectroscopie IR ? Comprendre ses frontières pour une analyse précise
- Quel solvant est normalement utilisé en spectroscopie IR ? Optimisez votre préparation d'échantillons pour des résultats plus clairs
- Quels sont les 3 types d'électrodes ? Un guide des électrodes anode, cathode, actives et inertes
- Quels sont les éléments du bio-fioul ? Décrypter la chimie du carburant renouvelable
- De quoi est composé le bio-fioul ? La chimie complexe d'un carburant durable
















