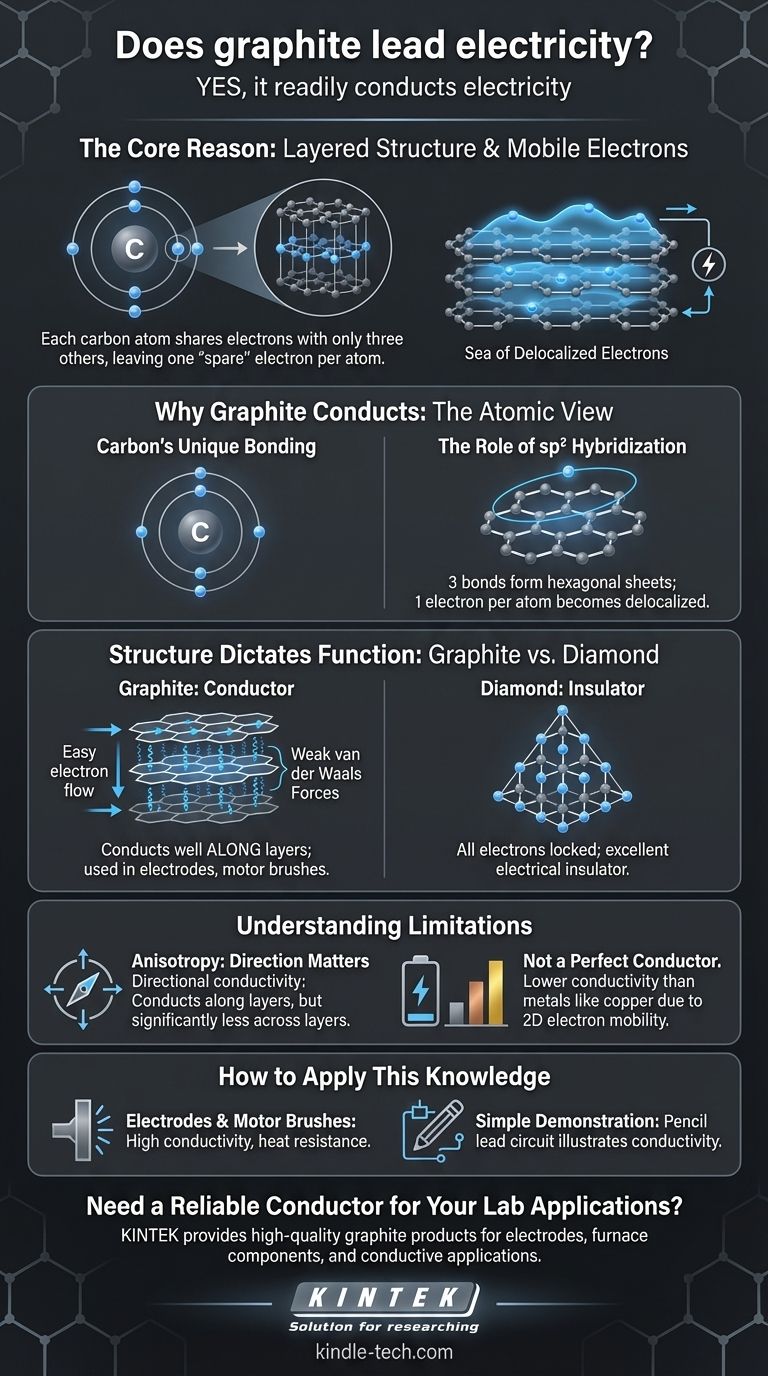
Oui, le graphite conduit facilement l'électricité. C'est l'un des rares non-métaux à être un conducteur électrique efficace, une propriété qui découle directement de sa structure atomique unique et du comportement de ses électrons.
La raison principale pour laquelle le graphite conduit l'électricité est sa structure en couches. Chaque atome de carbone partage des électrons avec seulement trois autres atomes, laissant un électron par atome libre de se déplacer le long de ces couches, créant une "mer" d'électrons mobiles qui peuvent transporter un courant électrique.

Pourquoi le graphite conduit l'électricité : la vue atomique
Pour comprendre la conductivité du graphite, nous devons examiner comment ses atomes de carbone sont arrangés et liés. L'explication réside dans un concept appelé délocalisation des électrons.
La liaison unique du carbone
Un atome de carbone possède quatre électrons de la couche externe (électrons de valence) disponibles pour la liaison. Dans de nombreux composés carbonés, comme le méthane ou le diamant, ces quatre électrons forment des liaisons fortes et localisées.
Le rôle de l'hybridation sp2
Dans le graphite, cependant, chaque atome de carbone n'utilise que trois de ses quatre électrons de valence pour former des liaisons covalentes fortes avec trois atomes voisins. Cet arrangement, connu sous le nom d'hybridation sp2, crée un réseau hexagonal plat, très similaire à un grillage.
Une "mer" d'électrons délocalisés
Cela laisse un électron par atome de carbone non lié. Ces électrons "supplémentaires" ne sont pas enfermés entre deux atomes spécifiques ; au lieu de cela, ils deviennent délocalisés, formant un nuage d'électrons en mouvement libre sur tout le plan de la feuille hexagonale. Lorsqu'une tension est appliquée, ces électrons mobiles circulent, créant un courant électrique.
La structure dicte la fonction : Graphite vs. Diamant
Le contraste entre le graphite et le diamant, deux formes pures de carbone, offre l'illustration la plus claire de la façon dont la structure atomique détermine les propriétés électriques.
Le réseau en couches du graphite
Le graphite est essentiellement constitué de feuilles empilées de ces couches de carbone hexagonales (maintenant connues sous le nom de graphène). Les électrons délocalisés se déplacent facilement le long de ces couches, rendant le graphite très conducteur dans cette direction.
Les couches elles-mêmes sont maintenues ensemble par des forces beaucoup plus faibles (forces de van der Waals), c'est pourquoi le graphite est glissant au toucher et est utilisé comme lubrifiant.
La forteresse rigide du diamant
Dans un diamant, chaque atome de carbone utilise ses quatre électrons de valence pour se lier à quatre autres atomes de carbone dans un réseau tétraédrique rigide et tridimensionnel. C'est ce qu'on appelle l'hybridation sp3.
Parce que tous les électrons sont enfermés dans des liaisons covalentes fortes et localisées, il n'y a pas d'électrons mobiles pour transporter un courant. Cela fait du diamant un excellent isolant électrique.
Comprendre les limitations
Bien que le graphite soit un conducteur, ses propriétés ne sont pas uniformes et il ne se comporte pas exactement comme un métal typique.
Anisotropie : la direction compte
Le graphite est un conducteur anisotrope. Cela signifie que sa conductivité est directionnelle. Il conduit l'électricité extrêmement bien le long de ses couches, mais est significativement moins conducteur à travers les couches. Les liaisons faibles entre les couches agissent comme une barrière au flux d'électrons.
Pas un conducteur parfait
Bien qu'il soit un bon conducteur pour un non-métal, sa conductivité est généralement inférieure à celle des métaux comme le cuivre, l'argent ou l'or. C'est parce que les métaux ont une mer d'électrons tridimensionnelle, tandis que la mobilité des électrons du graphite est principalement bidimensionnelle.
Comment appliquer ces connaissances
La compréhension des propriétés du graphite permet son utilisation dans un large éventail d'applications, des crayons de tous les jours aux appareils électroniques de haute technologie.
- Si votre objectif principal est de créer des électrodes ou des balais de moteur : La combinaison de la conductivité élevée, de la résistance à la chaleur et des propriétés autolubrifiantes du graphite en fait un choix idéal.
- Si votre objectif principal est les matériaux avancés : Reconnaissez qu'une seule couche de graphite est le graphène, un matériau aux propriétés électriques et mécaniques extraordinaires à l'échelle nanométrique.
- Si votre objectif principal est une simple démonstration de conductivité : Une "mine" de crayon ordinaire (qui est un mélange de graphite et d'argile) peut être utilisée pour dessiner un circuit conducteur sur papier, illustrant le principe de manière sûre et accessible.
En fin de compte, le graphite est un exemple parfait de la façon dont l'arrangement atomique d'un matériau dicte sa fonction dans le monde réel.
Tableau récapitulatif :
| Propriété | Graphite | Diamant |
|---|---|---|
| Conductivité électrique | Bon conducteur (le long des couches) | Excellent isolant |
| Liaison atomique | Hybridation sp2 (3 liaisons) | Hybridation sp3 (4 liaisons) |
| Comportement des électrons | Électrons délocalisés se déplaçant le long des couches | Tous les électrons sont enfermés dans des liaisons |
| Structure | Feuilles hexagonales en couches | Réseau tétraédrique rigide en 3D |
Besoin d'un conducteur fiable pour vos applications de laboratoire ?
Les propriétés uniques du graphite en font un matériau essentiel pour les électrodes, les composants de fours et d'autres applications conductrices à haute température.
Chez KINTEK, nous sommes spécialisés dans la fourniture d'équipements et de consommables de laboratoire de haute qualité, y compris des produits en graphite adaptés aux exigences rigoureuses de votre laboratoire. Notre expertise vous assure d'obtenir les bons matériaux pour un contrôle précis de la température, un chauffage uniforme et des performances durables.
Améliorez l'efficacité et la fiabilité de votre laboratoire—contactez nos experts dès aujourd'hui pour trouver la solution parfaite à vos besoins !
Guide Visuel
Produits associés
- Plaque de graphite carboné fabriquée par la méthode de pressage isostatique
- Four de graphitisation sous vide vertical à haute température
- Bateau en graphite carbone - Four tubulaire de laboratoire avec couvercle
- Grand four de graphitisation sous vide vertical en graphite
- Four de graphitation continue sous vide de graphite
Les gens demandent aussi
- Qu'est-ce que la méthode de fabrication par frittage ? Un guide de la fabrication à base de poudre
- Quels sont les 5 principaux traitements thermiques ? Maîtriser la dureté, la ténacité et la ductilité des métaux
- Quels sont les problèmes associés à la production de biomasse ? Les principaux obstacles environnementaux et économiques
- Quels sont les avantages des composants frittés ? Obtenez des pièces complexes et rentables avec un minimum de déchets
- Quels sont les types de fours de traitement thermique ? Un guide pour choisir la bonne technologie
- Quelle est l'inflammabilité du biochar ? Un guide pour comprendre et gérer son risque d'incendie
- Quel est le processus de fabrication du frittage ? Un guide sur la liaison des poudres à l'état solide
- Quelle est la règle des 20 dans le rotavapor ? Maîtriser l'évaporation et la récupération efficaces des solvants



















