Non, le graphite n'est pas un métal, mais c'est un excellent conducteur électrique. Cette distinction est une source de confusion fréquente, car on nous apprend souvent à associer la conductivité exclusivement aux éléments métalliques. Le graphite est un allotrope – une forme structurelle spécifique – de l'élément non métallique carbone.
La raison principale de cette confusion est que nous avons tendance à regrouper les matériaux par catégories simples plutôt que par leur structure fondamentale. Le graphite, bien que non métallique, conduit l'électricité parce que son arrangement atomique unique en couches crée des électrons "libres" qui se comportent presque exactement comme les électrons dans un vrai métal.

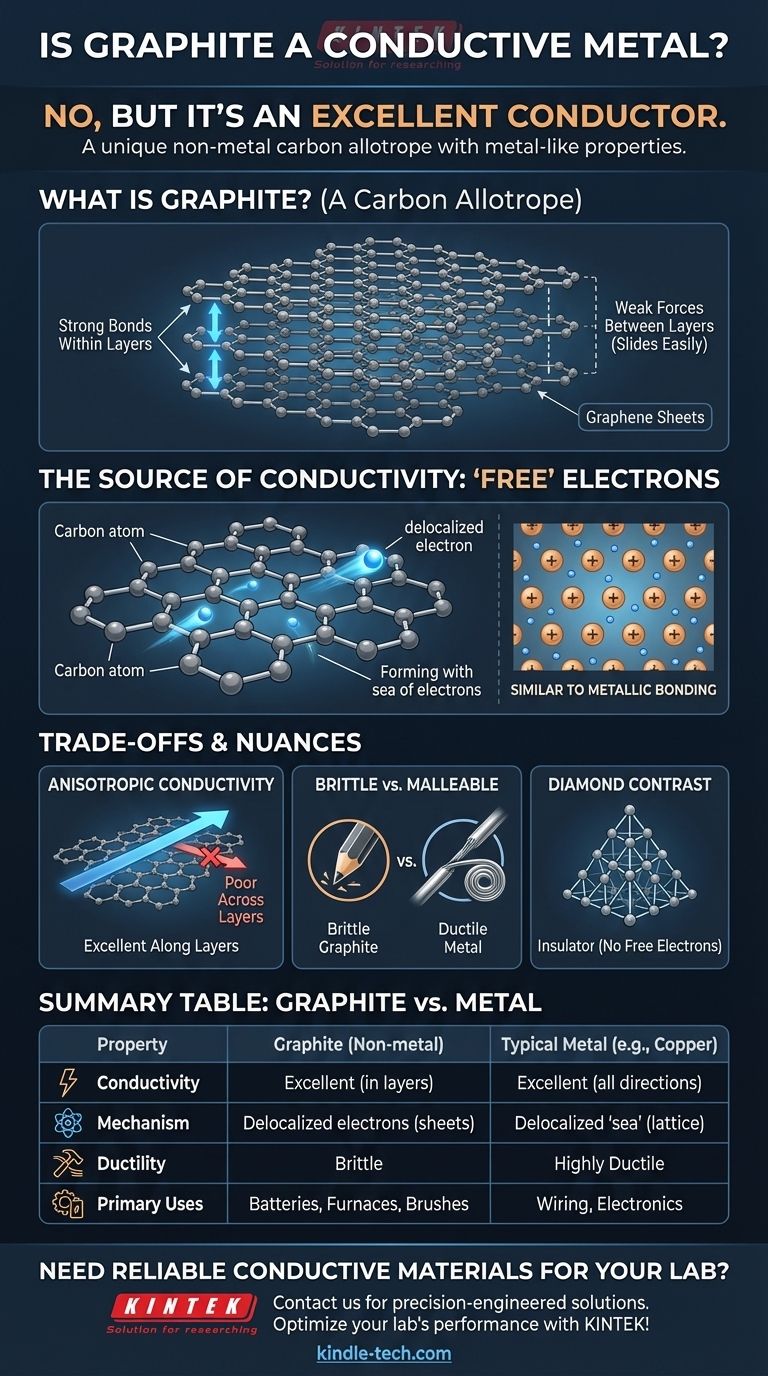
Qu'est-ce que le graphite ? Une forme unique de carbone
Les propriétés du graphite découlent directement de sa structure atomique unique. Comprendre cette structure est essentiel pour comprendre son comportement.
Pas un métal, mais un allotrope
Les éléments peuvent exister sous différentes formes physiques appelées allotropes. Ces formes ont les mêmes atomes mais des arrangements structurels différents, ce qui leur confère des propriétés très différentes.
Le graphite est un allotrope du carbone. L'autre allotrope le plus célèbre du carbone est le diamant. Bien que tous deux soient du carbone pur, leurs structures font du graphite un conducteur mou et du diamant un isolant dur.
Une structure de couches empilées
Le graphite est composé d'innombrables feuilles plates empilées les unes sur les autres. Chaque feuille, connue sous le nom de graphène, est une couche d'atomes de carbone d'une seule épaisseur, arrangée en un réseau hexagonal en nid d'abeille.
Les liaisons qui maintiennent les atomes ensemble au sein d'une feuille sont incroyablement fortes. Cependant, les forces qui maintiennent les différentes feuilles entre elles sont très faibles, ce qui leur permet de glisser facilement les unes sur les autres. C'est pourquoi le graphite est mou et feuilleté, formant la "mine" des crayons.
La source de la conductivité du graphite
La raison pour laquelle le graphite conduit l'électricité réside dans la façon dont ses électrons sont partagés – ou plutôt, non partagés. Cela imite le mécanisme conducteur des métaux sans que le graphite soit lui-même un métal.
Le rôle des électrons du carbone
Chaque atome de carbone possède quatre électrons externes (électrons de valence) disponibles pour la liaison. Dans la structure hexagonale d'une feuille de graphène, chaque atome de carbone forme de fortes liaisons covalentes avec trois atomes voisins.
L'électron délocalisé "libre"
Cela laisse un des quatre électrons de valence non lié. Ce quatrième électron n'est pas enfermé dans une liaison entre deux atomes spécifiques. Au lieu de cela, il devient délocalisé, libre de se déplacer n'importe où le long de sa feuille de graphène bidimensionnelle.
Une "mer d'électrons" dans un non-métal
Cette collection d'électrons délocalisés forme une "mer d'électrons" mobile au sein de chaque couche. Puisqu'un courant électrique est simplement le flux d'électrons, ces électrons libres permettent au graphite de conduire l'électricité avec facilité.
Ceci est fondamentalement similaire à la liaison métallique, où un réseau d'ions métalliques positifs est plongé dans une "mer" d'électrons partagés et délocalisés. Le graphite obtient un résultat similaire en utilisant une structure atomique complètement différente.
Comprendre les compromis et les nuances
Bien que le graphite soit un conducteur, il ne remplace pas parfaitement les métaux. Sa nature non métallique s'accompagne de compromis distincts.
La conductivité n'est pas uniforme
Le graphite est très anisotrope, ce qui signifie que ses propriétés dépendent de la direction. Il conduit l'électricité extrêmement bien le long de ses feuilles de graphène, mais très mal à travers celles-ci. La plupart des métaux, en revanche, sont isotropes et conduisent l'électricité aussi bien dans toutes les directions.
Fragilité vs. malléabilité
Les métaux sont généralement ductiles et malléables, ce qui signifie qu'ils peuvent être étirés en fils ou martelés en de nouvelles formes sans se casser. Le graphite est cassant et se brisera sous une contrainte similaire. Vous ne pouvez pas former un fil de graphite en l'étirant.
Le diamant : le contrepoint isolant
Le diamant offre un contraste parfait. Dans son réseau rigide et tétraédrique, chaque atome de carbone se lie à quatre autres, utilisant les quatre électrons de valence. Sans électrons délocalisés, il n'y a rien de libre pour se déplacer et transporter un courant, ce qui fait du diamant un excellent isolant électrique.
Faire le bon choix pour votre application
Comprendre ces principes vous permet de sélectionner le bon matériau en fonction des propriétés spécifiques requises pour une tâche.
- Si votre objectif principal est la conductivité flexible et omnidirectionnelle : Les métaux comme le cuivre et l'aluminium restent le choix supérieur en raison de leur ductilité et de leur nature isotrope.
- Si votre objectif principal est un conducteur léger et chimiquement stable pour les hautes températures : Le graphite est un matériau idéal pour des applications telles que les électrodes de batterie, les revêtements de four et les balais de moteurs électriques.
- Si votre objectif principal est la dureté et l'isolation électrique : Le diamant, l'autre allotrope célèbre du carbone, est la solution, prouvant que l'arrangement atomique dicte tout.
En fin de compte, les propriétés d'un matériau sont définies par sa structure atomique, et non par la simple catégorie dans laquelle nous le plaçons.
Tableau récapitulatif :
| Propriété | Graphite | Métal typique (ex. Cuivre) |
|---|---|---|
| Type de matériau | Non-métal (Allotrope de carbone) | Métal |
| Conductivité électrique | Excellente (dans les couches) | Excellente (dans toutes les directions) |
| Mécanisme de conduction | Électrons délocalisés dans les feuilles de graphène | « Mer d'électrons » délocalisés |
| Ductilité/Malléabilité | Cassant, ne peut pas être étiré en fils | Très ductile et malléable |
| Principales utilisations | Batteries, revêtements de fours, balais de moteurs | Câblage, composants structurels, électronique |
Besoin d'un matériau conducteur fiable pour votre application de laboratoire ? Que vous travailliez avec des fours à haute température, la recherche sur les batteries ou des configurations d'électrodes personnalisées, l'expertise de KINTEK en équipement et consommables de laboratoire vous assure d'obtenir la bonne solution. Notre équipe peut vous aider à sélectionner les matériaux qui correspondent à vos exigences spécifiques en matière de conductivité, de température et de durabilité. Contactez-nous dès aujourd'hui pour optimiser les performances de votre laboratoire avec des solutions d'ingénierie de précision de KINTEK !
Guide Visuel
Produits associés
- Électrode électrochimique en graphite, tige et plaque de graphite
- Plaque de graphite carboné fabriquée par la méthode de pressage isostatique
- Four de graphitisation sous vide vertical à haute température
- Grand four de graphitisation sous vide vertical en graphite
- Four de graphitation continue sous vide de graphite
Les gens demandent aussi
- Quels sont les avantages du frittage ? Obtenez des propriétés matérielles supérieures et une production rentable
- Quels sont les quatre principaux types de capteurs ? Un guide sur la source d'alimentation et le type de signal
- Quel est le principe de fonctionnement de la technique de dépôt physique en phase vapeur ? | Explication du revêtement atome par atome
- Quelles sont les alternatives à la gestion des déchets plastiques ? Un guide des solutions circulaires
- Qu'est-ce que la pulvérisation cathodique d'or pour le MEB ? Prévenir la charge et améliorer la qualité d'image pour les échantillons non conducteurs
- Quel est le processus de traitement thermique standard ? Un cadre pour atteindre les propriétés matérielles souhaitées
- Quel est le produit final de la pyrolyse rapide ? Maximiser le rendement en bio-huile pour les carburants renouvelables
- À quoi sert une machine de pulvérisation cathodique ? Obtenez des revêtements en couches minces de précision pour la fabrication de haute technologie



















