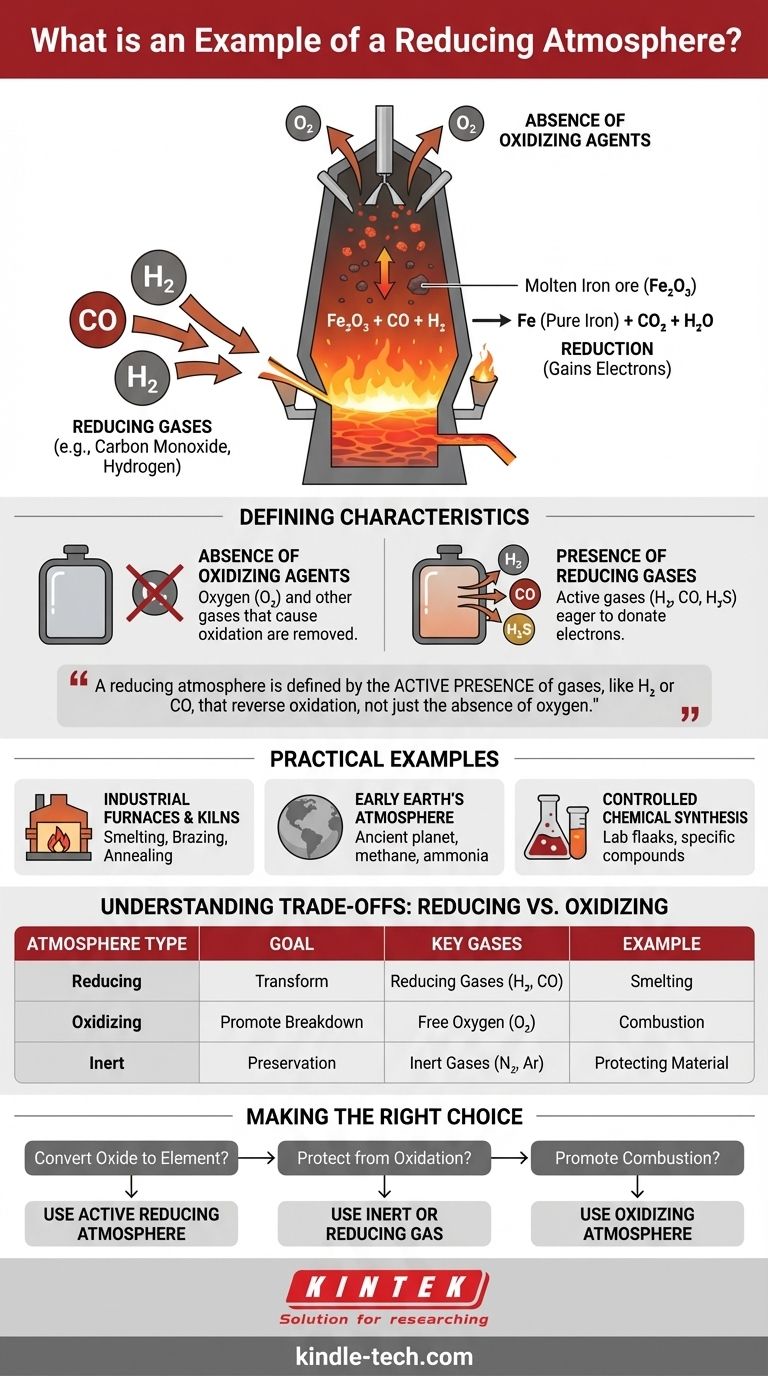
Un exemple classique d'atmosphère réductrice est l'environnement à l'intérieur d'un haut fourneau utilisé pour la fonte du minerai de fer. Dans ce processus à haute température, l'oxygène est délibérément retiré et du monoxyde de carbone est introduit, créant une condition qui dépouille activement les atomes d'oxygène du minerai de fer, le « réduisant » ainsi en fer métallique pur.
Le point essentiel à retenir est qu'une atmosphère réductrice ne signifie pas simplement l'absence d'oxygène ; elle est définie par la présence active de gaz, tels que l'hydrogène ou le monoxyde de carbone, qui sont chimiquement enclins à donner des électrons et à inverser le processus d'oxydation.

Qu'est-ce qui définit une atmosphère « réductrice » ?
Pour saisir pleinement le concept, il est essentiel de comprendre ses deux caractéristiques déterminantes : ce qui est absent et ce qui est présent.
L'absence d'agents oxydants
La première étape pour créer une atmosphère réductrice est l'élimination de l'oxygène et d'autres gaz qui provoquent l'oxydation.
L'atmosphère de notre quotidien est une atmosphère oxydante. C'est la raison pour laquelle une tranche de pomme brunit et que le fer rouille. Ces processus sont entraînés par la présence d'oxygène libre.
La présence de gaz réducteurs
Une véritable atmosphère réductrice contient des agents réducteurs actifs. Ce sont des gaz chimiquement instables et désireux de donner des électrons à d'autres substances.
Les exemples courants comprennent l'hydrogène (H₂), le monoxyde de carbone (CO) et le sulfure d'hydrogène (H₂S). Ces gaz cherchent activement des atomes d'oxygène dans d'autres matériaux et s'y lient.
La réaction chimique (Réduction)
Cet environnement facilite une réaction chimique appelée réduction. En chimie, la réduction se produit lorsqu'un atome ou une molécule gagne des électrons, abaissant ainsi son état d'oxydation.
Dans l'exemple du haut fourneau, le monoxyde de carbone (CO) donne des électrons à l'oxyde de fer (Fe₂O₃), qui les gagne. Cela réduit le minerai de fer en fer élémentaire (Fe).
Exemples pratiques dans la nature et l'industrie
Comprendre où se produisent ces atmosphères aide à solidifier le concept et son importance.
Fours et réchauffeurs industriels
La fusion, le brasage et le recuit des métaux sont souvent effectués sous atmosphère réductrice. Cela empêche la formation d'oxydes (calamine ou rouille) à la surface du métal à haute température, garantissant un produit final propre et solide.
L'atmosphère de la Terre primitive
Il y a des milliards d'années, avant l'apparition de la vie photosynthétique, l'atmosphère terrestre était naturellement réductrice. Elle était riche en gaz tels que le méthane, l'ammoniac et la vapeur d'eau, mais contenait pratiquement pas d'oxygène libre.
Synthèse chimique contrôlée
Dans les laboratoires et les usines chimiques, des atmosphères réductrices sont créées pour produire des composés chimiques spécifiques. L'environnement contrôlé garantit que seule la réaction de réduction souhaitée se produit sans interférence d'une oxydation indésirable.
Comprendre les compromis : Réductrice vs Oxydante
Le choix entre créer une atmosphère réductrice, inerte ou oxydante est une décision d'ingénierie critique dictée par le résultat souhaité. Les compromis sont fondamentaux.
Objectif : Transformation vs Préservation
Une atmosphère oxydante favorise la décomposition (rouille, combustion). Une atmosphère réductrice favorise la transformation en éliminant l'oxygène des composés. Une atmosphère inerte (comme l'argon pur) est utilisée pour la préservation, empêchant toute réaction de se produire.
Le défi de la sécurité et du contrôle
Les atmosphères réductrices impliquent souvent des gaz qui sont soit inflammables (hydrogène), soit toxiques (monoxyde de carbone). Le maintien de ces conditions, surtout à haute température, nécessite des contrôles d'ingénierie sophistiqués pour assurer la sécurité et l'efficacité du processus.
Coût et complexité
Créer et maintenir une condition atmosphérique spécifique représente une couche supplémentaire de complexité et de coût. Cependant, pour de nombreux processus industriels, ce contrôle n'est pas facultatif : c'est la seule façon de produire le matériau souhaité.
Faire le bon choix pour votre objectif
Votre compréhension des conditions atmosphériques doit être directement liée à l'objectif chimique que vous souhaitez atteindre.
- Si votre objectif principal est de convertir un oxyde en son élément pur (par exemple, minerai en métal) : Vous avez besoin d'une atmosphère réductrice active contenant un gaz tel que le monoxyde de carbone ou l'hydrogène.
- Si votre objectif principal est de protéger un matériau contre l'oxydation de surface pendant le traitement thermique : Vous devez déplacer l'oxygène, ce qui peut être fait avec un gaz inerte (comme l'azote ou l'argon) ou un gaz réducteur.
- Si votre objectif principal est la combustion ou la simulation de l'altération naturelle : Vous avez besoin d'une atmosphère oxydante, spécifiquement une avec une quantité contrôlée d'oxygène.
En fin de compte, la nature d'une atmosphère est définie par les réactions chimiques qu'elle favorise et celles qu'elle empêche.
Tableau récapitulatif :
| Caractéristique | Atmosphère Réductrice | Atmosphère Oxydante |
|---|---|---|
| Objectif Principal | Transformer les matériaux (ex. minerai en métal) | Favoriser la décomposition (ex. combustion, rouille) |
| Absence Clé | Oxygène Libre (O₂) | N/A |
| Présence Clé | Gaz Réducteurs (H₂, CO) | Oxygène Libre (O₂) |
| Processus Exemple | Fonte du fer dans un haut fourneau | Combustion de carburant, altération naturelle |
Besoin d'un contrôle atmosphérique précis pour vos processus de laboratoire ? KINTEK est spécialisé dans l'équipement et les consommables de laboratoire, fournissant les outils et l'expertise nécessaires pour créer et gérer les environnements réducteurs, inertes ou oxydants exacts requis par votre recherche ou votre production. Assurez la pureté et la qualité de vos matériaux — contactez nos experts dès aujourd'hui pour discuter de votre application spécifique !
Guide Visuel
Produits associés
- Four à atmosphère contrôlée 1200℃ Four à atmosphère inerte d'azote
- Four à atmosphère d'hydrogène contrôlée à l'azote
- Four à atmosphère contrôlée de 1400℃ avec atmosphère d'azote et inerte
- Four à atmosphère contrôlée 1700℃ Four à atmosphère inerte d'azote
- Four rotatif à tubes multiples zones chauffantes divisées
Les gens demandent aussi
- Qu'est-ce que le traitement thermique sous atmosphère inerte ? Protégez vos métaux de l'oxydation et de la décarburation
- Qu'est-ce qu'une atmosphère inerte ? Un guide pour prévenir l'oxydation et assurer la sécurité
- Qu'est-ce qui fournit une atmosphère inerte ? Atteignez la sécurité et la pureté avec l'azote, l'argon ou le CO2
- Quel est un exemple d'atmosphère inerte ? Découvrez le meilleur gaz pour votre procédé
- Quel est l'objectif d'une atmosphère inerte ? Un guide pour protéger vos matériaux et vos processus



















