Pour l'imagerie infrarouge (IR) d'échantillons biologiques, la technique la plus largement utilisée et la plus puissante est la microspectroscopie infrarouge à transformée de Fourier (FTIR). Cette méthode combine un spectromètre IR standard avec un microscope, vous permettant de générer des images chimiquement spécifiques qui révèlent la distribution spatiale de biomolécules clés comme les protéines, les lipides et les acides nucléiques au sein d'une coupe de tissu ou d'un groupe de cellules.
Le défi principal de l'imagerie IR en biologie n'est pas seulement de choisir une technique, mais de gérer le signal IR écrasant de l'eau, qui peut masquer les données moléculaires que vous recherchez. Par conséquent, votre choix de l'instrument et de la méthode de préparation de l'échantillon est essentiel pour le succès.
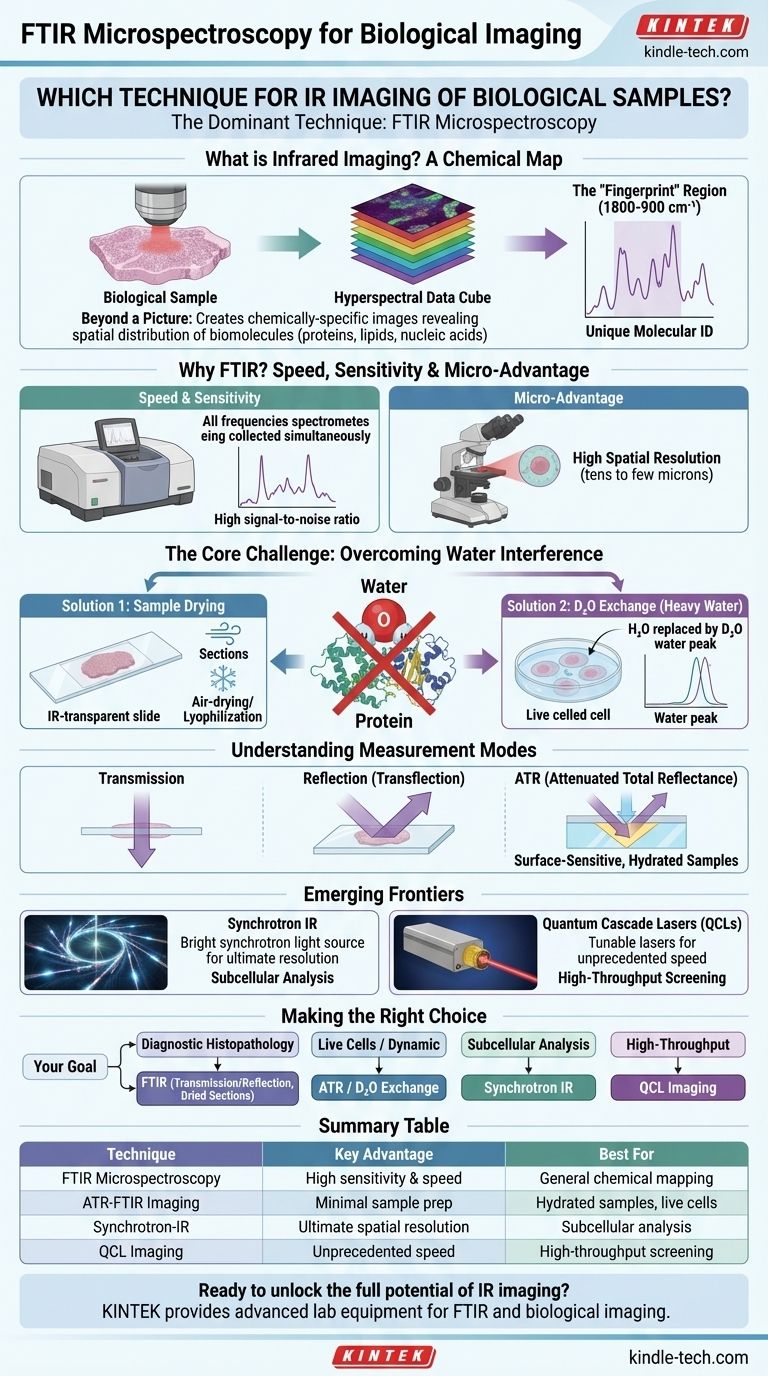
Qu'est-ce que l'imagerie infrarouge ? Une carte chimique
L'imagerie infrarouge, également connue sous le nom de microspectroscopie vibrationnelle, est fondamentalement différente de la microscopie optique standard. Au lieu de simplement visualiser la morphologie, elle fournit des informations sur la composition chimique de l'échantillon.
Au-delà d'une image : Créer une image hyperspectrale
Un microscope IR mesure un spectre infrarouge complet à chaque pixel de l'image. Cela crée un "cube de données hyperspectrales", qui est une pile d'images où chaque couche correspond à l'absorption de la lumière à une fréquence IR spécifique.
En analysant ces données, vous pouvez générer des images en fausses couleurs qui cartographient la concentration et la distribution de composants chimiques spécifiques à travers votre échantillon.
La région "empreinte digitale" : Identification des molécules clés
La région du moyen infrarouge du spectre (environ 4000-400 cm⁻¹) provoque la vibration des molécules. Différentes liaisons chimiques (comme C=O dans les protéines, C-H dans les lipides) vibrent à des fréquences caractéristiques.
La région allant d'environ 1800 à 900 cm⁻¹ est connue sous le nom de "région d'empreinte digitale" car elle contient un motif complexe de pics qui est unique à une molécule spécifique. En analysant cette région, vous pouvez identifier et quantifier les principales classes de biomolécules.
La technique dominante : la microspectroscopie FTIR
Bien que d'autres méthodes existent, la microspectroscopie FTIR est l'outil de prédilection dans ce domaine pour son équilibre entre sensibilité, rapidité et polyvalence.
Pourquoi la FTIR ? Rapidité et sensibilité
Les instruments infrarouges à transformée de Fourier (FTIR) modernes collectent toutes les fréquences de lumière simultanément, un avantage significatif par rapport aux méthodes plus anciennes. Il en résulte un rapport signal/bruit beaucoup plus élevé et des temps d'acquisition considérablement plus rapides, ce qui est essentiel pour cartographier de grandes zones d'un échantillon biologique.
L'avantage "micro" : Résolution spatiale
L'association du spectromètre FTIR à un microscope permet de focaliser le faisceau IR sur une petite tache. En balayant ce faisceau sur l'échantillon ou en utilisant un détecteur à réseau de plans focaux (FPA), vous pouvez construire l'image hyperspectrale pixel par pixel, résolvant des caractéristiques à l'échelle de dizaines de microns jusqu'à quelques microns.
Le défi principal : surmonter les interférences de l'eau
Le plus grand obstacle dans l'analyse IR d'échantillons biologiques est l'eau.
Pourquoi l'eau est un problème
Le H₂O liquide présente des bandes d'absorption extrêmement fortes et larges dans la gamme du moyen IR, en particulier autour de 1640 cm⁻¹. Ce signal est si intense qu'il peut complètement saturer le détecteur et masquer la bande cruciale Amide I des protéines, essentielle pour l'étude de la structure et de la concentration des protéines.
Solution 1 : Séchage et fixation de l'échantillon
L'approche la plus courante consiste à éliminer l'eau. Les tissus biologiques sont généralement coupés à l'aide d'un microtome, placés sur une lame spéciale transparente aux IR (comme le CaF₂ ou le BaF₂), puis séchés.
Cela peut être fait par séchage à l'air, lyophilisation (séchage par congélation) ou en utilisant des fixateurs chimiques comme le formol ou l'éthanol, similaires à l'histologie standard. Cela élimine efficacement le signal de l'eau, fournissant des spectres propres et de haute qualité des biomolécules restantes.
Solution 2 : Échange isotopique avec de l'eau lourde (D₂O)
Pour étudier des échantillons dans un état plus "natif" ou hydraté, comme les cellules vivantes, le H₂O peut être échangé avec de l'oxyde de deutérium (D₂O), ou "eau lourde".
La liaison O-D dans le D₂O absorbe à une fréquence beaucoup plus basse (environ 1210 cm⁻¹), déplaçant le pic massif de l'eau et révélant les signaux des protéines, des lipides et des acides nucléiques dans la région d'empreinte digitale.
Comprendre les compromis : Modes de mesure
La manière dont la lumière IR interagit avec votre échantillon est un autre choix crucial, chaque mode offrant des avantages distincts.
Transmission
En mode transmission, le faisceau IR passe directement à travers un échantillon très fin. Ce mode fournit généralement les spectres les plus quantifiables et de la plus haute qualité, mais nécessite des coupes de tissus minces méticuleusement préparées (généralement 5-10 µm).
Réflexion (Transflection)
Plus communément, les échantillons sont analysés en mode transflection. Le tissu est placé sur une lame réfléchissante (comme une lame miroir ou Low-e). Le faisceau IR traverse l'échantillon, se réfléchit sur la surface de la lame et retraverse l'échantillon jusqu'au détecteur. C'est plus pratique mais peut parfois introduire des artefacts spectraux.
Réflectance totale atténuée (ATR)
L'imagerie ATR-FTIR est une technique puissante sensible à la surface. L'échantillon est mis en contact ferme avec un cristal à indice de réfraction élevé (comme le germanium). La lumière IR ne traverse pas l'échantillon ; au lieu de cela, une "onde évanescente" pénètre seulement quelques microns dans la surface de l'échantillon.
C'est excellent pour obtenir des spectres de haute qualité à partir de la surface d'échantillons épais ou fortement absorbants sans aucune préparation. Sa courte longueur de trajet minimise naturellement les interférences de l'eau, ce qui en fait un excellent choix pour l'analyse d'échantillons hydratés.
Frontières émergentes en bio-imagerie IR
Le domaine est en constante évolution avec de nouvelles technologies qui repoussent les limites de la vitesse et de la résolution.
IR Synchrotron : Pour une résolution ultime
L'utilisation d'une source de lumière synchrotron fournit un faisceau IR jusqu'à 1000 fois plus brillant qu'une source thermique conventionnelle. Cela permet une résolution spatiale limitée par la diffraction, rendant possible l'imagerie chimique de cellules uniques et même d'organites subcellulaires.
Lasers à cascade quantique (QCL) : Pour une vitesse sans précédent
Au lieu d'une source thermique large, ces systèmes utilisent des lasers puissants et accordables. Bien qu'ils ne collectent généralement pas le spectre complet, ils peuvent être réglés sur quelques fréquences clés pour cartographier des molécules spécifiques (comme les protéines totales ou les lipides) sur de très grandes surfaces en quelques minutes, plutôt qu'en heures. Cela transforme le potentiel des applications cliniques à haut débit.
Faire le bon choix pour votre objectif
Votre choix de technique et de préparation d'échantillon dépend entièrement de votre question de recherche.
- Si votre objectif principal est l'histopathologie diagnostique : Utilisez la microspectroscopie FTIR en mode transmission ou transflection sur des coupes de tissus minces, séchées et fixées pour identifier les marqueurs biochimiques de la maladie.
- Si votre objectif principal est d'étudier des cellules vivantes ou des processus dynamiques : Envisagez l'imagerie ATR-FTIR ou travaillez dans une cellule liquide scellée après avoir échangé le milieu avec du D₂O pour maintenir un environnement hydraté.
- Si votre objectif principal est l'analyse chimique subcellulaire : Vous aurez probablement besoin de la haute luminosité et de la résolution spatiale offertes par une source IR Synchrotron.
- Si votre objectif principal est le criblage à haut débit de nombreux échantillons : L'imagerie basée sur les QCL offre la vitesse requise pour cartographier rapidement la distribution de quelques biomarqueurs clés.
En fin de compte, maîtriser l'imagerie infrarouge d'échantillons biologiques consiste à contrôler vos variables pour isoler les signaux moléculaires qui comptent le plus.
Tableau récapitulatif :
| Technique | Avantage clé | Idéal pour |
|---|---|---|
| Microspectroscopie FTIR | Haute sensibilité et rapidité | Cartographie chimique générale des tissus |
| Imagerie ATR-FTIR | Préparation minimale de l'échantillon, sensible à la surface | Échantillons hydratés, cellules vivantes |
| IR Synchrotron | Résolution spatiale ultime | Analyse subcellulaire |
| Imagerie QCL | Vitesse sans précédent | Criblage à haut débit |
Prêt à libérer tout le potentiel de l'imagerie IR dans votre recherche ? KINTEK est spécialisé dans la fourniture d'équipements de laboratoire et de consommables avancés pour tous vos besoins en imagerie FTIR et biologique. Que vous travailliez avec des coupes de tissus, des cellules vivantes ou que vous ayez besoin de solutions à haut débit, nos experts peuvent vous aider à sélectionner les bons outils pour obtenir des résultats précis et chimiquement spécifiques. Contactez-nous dès aujourd'hui pour discuter de la manière dont nous pouvons soutenir le succès de votre laboratoire !
Guide Visuel
Produits associés
- Presse hydraulique de laboratoire pour applications XRF KBR FTIR
- Presse à pastilles Kbr 2t
- Système RF PECVD Dépôt chimique en phase vapeur assisté par plasma à radiofréquence RF PECVD
- Instrument de tamisage électromagnétique tridimensionnel
- Trancheuse de laboratoire manuelle
Les gens demandent aussi
- Quelles sont les applications du brasage ? Assembler des métaux dissemblables avec des liaisons solides et étanches
- Le verre est-il fabriqué par frittage ? La vérité sur la formation du verre
- Comment dégivrer les congélateurs à température ultra-basse ? Protégez vos échantillons et votre équipement
- Quels sont les avantages et les inconvénients du processus SLS ? Débloquez des pièces complexes et fonctionnelles
- Comment les laboratoires peuvent-ils garantir que leurs congélateurs ULT fonctionnent de manière optimale au fil du temps ? Un guide de maintenance proactive
- Quels sont les inconvénients du frittage ? Coûts élevés et défis de contrôle des processus
- Le KBr absorbe-t-il le rayonnement IR ? Pourquoi est-il la matrice de choix pour des spectres nets
- Pourquoi un flux continu d'azote de haute pureté est-il requis pendant la pyrolyse catalytique des plastiques ? Maximiser le rendement en carburant







