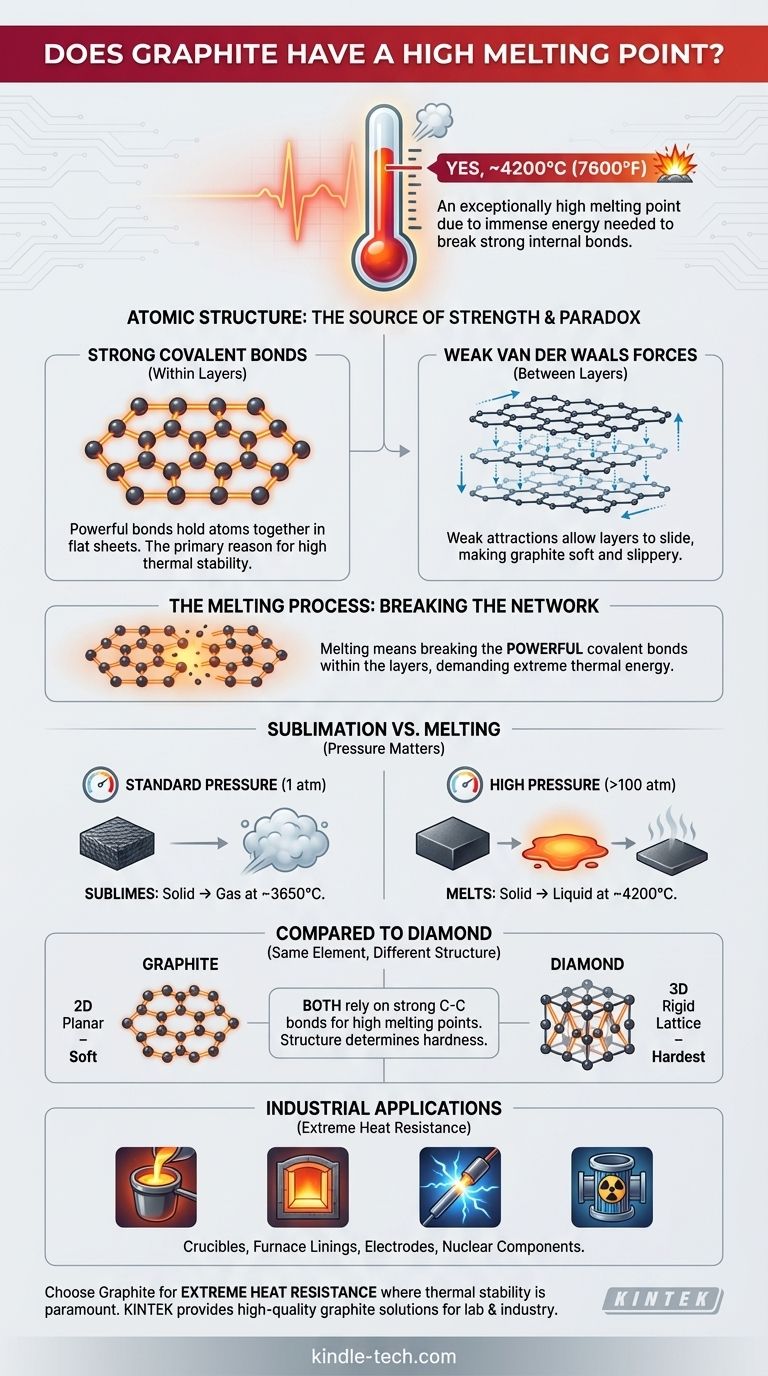
Oui, le graphite a un point de fusion exceptionnellement élevé. Cette propriété est une conséquence directe de sa structure atomique, qui nécessite une immense quantité d'énergie pour être brisée. Bien que son point de fusion exact puisse varier avec la pression, il est souvent cité comme étant d'environ 4200°C (7600°F).
Le point de fusion élevé du graphite n'est pas dû aux forces faibles entre ses couches (qui le rendent mou), mais aux liaisons covalentes incroyablement fortes qui maintiennent les atomes de carbone ensemble au sein de chaque couche. Pour faire fondre le graphite, il faut briser ces puissantes liaisons internes, un processus qui exige des températures extrêmes.

La source de la force du graphite : la liaison atomique
La raison de la nature apparemment contradictoire du graphite – étant à la fois mou et ayant un point de fusion élevé – réside dans deux types de forces chimiques différentes agissant simultanément.
Fortes liaisons covalentes au sein des couches
Le graphite est composé d'atomes de carbone disposés en feuilles plates et hexagonales, un peu comme un nid d'abeille. Au sein de chaque feuille, chaque atome de carbone est lié à trois autres par de fortes liaisons covalentes.
Ces liaisons comptent parmi les liaisons chimiques les plus stables et les plus puissantes de la nature. Elles sont la principale source de la stabilité thermique et du point de fusion élevé du graphite.
Faibles forces de van der Waals entre les couches
Alors que les atomes au sein d'une feuille sont fortement liés, les feuilles elles-mêmes sont empilées les unes sur les autres et maintenues ensemble par des forces beaucoup plus faibles appelées forces de van der Waals.
Ces faibles attractions sont facilement surmontées, permettant aux couches de glisser les unes sur les autres. C'est ce qui confère au graphite sa douceur, son caractère glissant et son utilité en tant que lubrifiant.
Ce que signifie réellement la "fusion" pour le graphite
Comprendre le processus de fusion est essentiel pour résoudre le paradoxe des propriétés du graphite.
Briser le réseau covalent
Faire fondre une substance implique de donner à ses atomes suffisamment d'énergie pour qu'ils se libèrent de leurs positions fixes. Pour le graphite, cela ne signifie pas séparer les couches, mais plutôt briser les fortes liaisons covalentes au sein des couches elles-mêmes.
Surmonter la force de ces liaisons C-C nécessite un apport massif d'énergie thermique, c'est pourquoi la température doit être si incroyablement élevée.
Sublimation vs. fusion
Il est important de noter que sous pression atmosphérique standard, le graphite ne fond pas réellement. Au lieu de cela, il se sublime – passant directement de l'état solide à l'état gazeux – à environ 3650°C.
Atteindre un véritable état liquide pour le carbone nécessite généralement l'application d'une haute pression (plus de 100 atmosphères) pour empêcher les atomes de se disperser immédiatement en gaz.
Comprendre le contexte et les compromis
Les propriétés du graphite sont mieux comprises lorsqu'elles sont comparées à d'autres matériaux, en particulier son célèbre allotrope, le diamant.
La comparaison avec le diamant
Le diamant et le graphite sont tous deux composés uniquement de carbone, et tous deux ont des points de fusion/sublimation extrêmement élevés. Cela est dû à la force des liaisons covalentes carbone-carbone.
La différence de leur dureté provient de l'arrangement des liaisons. Le diamant possède un réseau 3D rigide de liaisons covalentes, ce qui en fait le matériau naturel le plus dur. Le graphite a une structure planaire 2D avec des forces faibles entre les couches, ce qui le rend mou.
Le point clé à retenir est que le point de fusion est déterminé par la force des liaisons, tandis que la dureté physique est déterminée par la structure et l'arrangement des liaisons.
Implications pratiques
Le point de fusion élevé du graphite en fait un matériau industriel indispensable. Il est utilisé pour fabriquer :
- Des creusets pour contenir et faire fondre les métaux.
- Des revêtements pour les fours à haute température.
- Des électrodes dans les fours à arc électrique qui peuvent atteindre des milliers de degrés.
- Des composants dans les réacteurs nucléaires qui doivent résister à une chaleur extrême.
Faire le bon choix pour votre objectif
Comprendre cette propriété vous permet de sélectionner et d'utiliser des matériaux en fonction de leur structure fondamentale.
- Si votre objectif principal est une résistance extrême à la chaleur : Le graphite est un excellent candidat, car ses fortes liaisons covalentes internes offrent une immense stabilité thermique.
- Si votre objectif principal est la lubrification solide : La structure en couches du graphite est idéale, mais sachez que ses propriétés lubrifiantes sont soutenues par une structure qui ne fondra pas ou ne se dégradera pas à haute température.
- Si votre objectif principal est de comprendre la science des matériaux : Distinguez toujours les propriétés dérivées des liaisons atomiques (comme le point de fusion) de celles dérivées de la structure globale (comme la douceur ou la dureté).
En fin de compte, la double nature du graphite, à la fois mou et extrêmement résistant à la chaleur, est le résultat direct des deux types distincts de liaisons qui définissent sa structure.
Tableau récapitulatif :
| Propriété | Valeur/Description |
|---|---|
| Point de fusion | ~4200°C (7600°F) (sous haute pression) |
| Point de sublimation | ~3650°C (à pression standard) |
| Caractéristique structurelle clé | Fortes liaisons covalentes au sein des couches de carbone 2D |
| Applications industrielles | Creusets, revêtements de fours, électrodes, composants de réacteurs nucléaires |
Besoin d'un partenaire fiable pour les applications à haute température ?
La stabilité thermique exceptionnelle du graphite le rend idéal pour les processus de laboratoire et industriels exigeants. KINTEK est spécialisé dans la fourniture d'équipements de laboratoire et de consommables de haute qualité, y compris des solutions à base de graphite comme les creusets et les composants de fours, conçus pour résister à des conditions extrêmes.
Laissez nos experts vous aider à sélectionner les bons matériaux pour vos besoins spécifiques. Contactez KINTEK dès aujourd'hui pour améliorer les capacités et l'efficacité de votre laboratoire.
Guide Visuel
Produits associés
- Four de graphitation continue sous vide de graphite
- Four de graphitisation sous vide vertical à haute température
- Four de graphitisation de film de haute conductivité thermique sous vide de graphite
- Four de graphitation sous vide à ultra-haute température au graphite
- Four de Graphitization Expérimental à Vide de Graphite IGBT
Les gens demandent aussi
- Quel est le niveau de vide d'un évaporateur thermique ? Atteignez la pureté avec un vide poussé (10⁻⁵ à 10⁻⁷ Torr)
- Quels sont les facteurs qui affectent le frittage ? Maîtrisez les variables clés pour une densification optimale
- Le verre est-il fabriqué par frittage ? La vérité sur la formation du verre
- Comment fonctionne le point de fusion mixte ? Confirmez l'identité d'un composé avec la dépression du point de fusion
- Quelles sont les limites et les inconvénients de la métallurgie des poudres ? Comprendre les compromis pour votre application
- La pyrolyse du plastique est-elle nocive ? La vérité sur les sous-produits toxiques et les risques environnementaux
- Quelles précautions prendre lors du brasage ? Un guide pour la manipulation sécurisée des fumées, du feu et des produits chimiques
- Combien de types de dépôt physique en phase vapeur existe-t-il ? Les 4 principaux procédés PVD expliqués



















