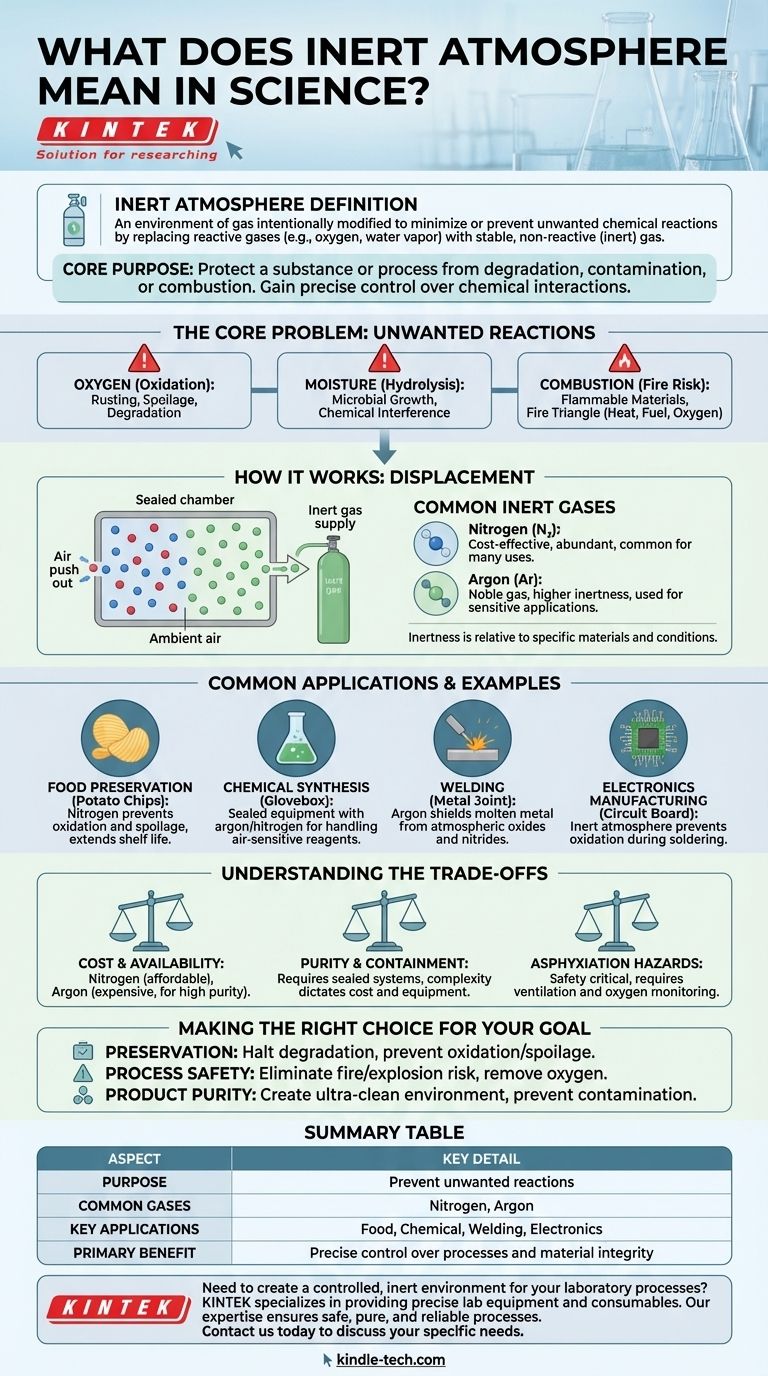
Dans un contexte scientifique, une atmosphère inerte fait référence à un environnement gazeux qui a été intentionnellement modifié pour minimiser ou prévenir les réactions chimiques indésirables. Ceci est réalisé en remplaçant les gaz réactifs, le plus souvent l'oxygène et la vapeur d'eau, par un gaz stable et non réactif (ou "inerte") comme l'azote ou l'argon.
L'objectif principal de la création d'une atmosphère inerte est de protéger une substance ou un processus de la dégradation, de la contamination ou de la combustion. En éliminant les éléments réactifs de l'environnement, vous obtenez un contrôle précis sur les interactions chimiques qui peuvent se produire.

Le problème fondamental : les réactions indésirables
Pour comprendre pourquoi les atmosphères inertes sont nécessaires, nous devons d'abord identifier les problèmes qu'elles résolvent. L'air ambiant est un mélange de gaz étonnamment réactif et souvent hostile aux matériaux et processus sensibles.
Le rôle de l'oxygène
L'oxygène est le coupable le plus courant. Il est très réactif et participe facilement à l'oxydation, un processus qui peut altérer fondamentalement les matériaux.
Cela inclut la rouille des métaux, la détérioration des aliments et la dégradation des composés chimiques sensibles.
L'impact de l'humidité
La vapeur d'eau présente dans l'air est une autre source majeure de réactions indésirables. Elle peut hydrolyser des matériaux sensibles, favoriser la croissance microbienne ou interférer avec la synthèse chimique.
Le risque de combustion
De nombreux processus impliquent des matériaux inflammables ou des températures élevées. La présence d'oxygène crée un risque important d'incendie ou d'explosion, car il est un composant clé du triangle du feu (chaleur, combustible et oxygène).
Comment fonctionne une atmosphère inerte
La solution est conceptuellement simple : remplacer l'atmosphère réactive par une atmosphère non réactive. Ceci est généralement réalisé par un processus de purge ou de déplacement.
Le principe du déplacement
Le processus consiste à rincer un récipient ou une chambre scellée (comme une boîte à gants ou un réacteur) avec un gaz inerte. Ce nouveau gaz expulse physiquement l'air ambiant, remplaçant efficacement l'oxygène et l'humidité réactifs par un gaz stable.
Gaz inertes courants
Le choix du gaz dépend de l'application spécifique, du coût et du niveau d'inertie requis.
Le plus courant est l'azote (N₂), qui est efficace pour de nombreuses applications et relativement peu coûteux. Pour des situations de pureté plus élevée ou plus exigeantes, des gaz nobles comme l'argon (Ar) sont utilisés car ils sont encore moins réactifs.
Le concept d'"inertie"
Il est important de comprendre que "inerte" est un terme relatif. Un gaz est considéré comme inerte s'il ne réagit pas avec les matériaux spécifiques d'un système donné dans des conditions spécifiques. L'azote, par exemple, est inerte pour la plupart des usages mais peut réagir à très hautes températures et pressions.
Applications et exemples courants
L'utilisation pratique des atmosphères inertes est répandue dans la science et l'industrie, souvent de manière que vous rencontrez quotidiennement.
Dans la conservation des aliments
L'air à l'intérieur d'un sac de croustilles n'est pas seulement de l'"air" – c'est généralement de l'azote. Cette atmosphère inerte empêche les huiles des croustilles de s'oxyder et de rancir, prolongeant considérablement leur durée de conservation.
Dans la synthèse chimique
De nombreux réactifs chimiques sont extrêmement sensibles à l'air ou à l'humidité. Les chimistes utilisent des équipements scellés rincés à l'argon ou à l'azote pour manipuler ces matériaux, garantissant que leurs réactions se déroulent comme prévu sans contamination.
Dans le soudage et la métallurgie
Lors du soudage d'alliages à haute résistance, un gaz inerte comme l'argon est utilisé pour protéger le métal en fusion de l'atmosphère. Cela empêche la formation d'oxydes et de nitrures qui affaibliraient autrement la soudure.
Dans la fabrication électronique
Lors du brasage de micropuces et de cartes de circuits imprimés, les composants sont vulnérables à l'oxydation. Une atmosphère inerte empêche cela, assurant la formation de connexions électriques solides et fiables.
Comprendre les compromis
Bien que puissante, la mise en œuvre d'une atmosphère inerte implique des considérations pratiques qui doivent être prises en compte.
Coût et disponibilité
L'azote est abondant et abordable, ce qui en fait le cheval de bataille de nombreuses applications industrielles. L'argon de haute pureté et les autres gaz nobles sont significativement plus chers et sont réservés aux cas où une non-réactivité absolue est critique.
Pureté et confinement
Le maintien d'une atmosphère véritablement inerte nécessite des systèmes bien scellés. Le niveau de pureté requis dicte la complexité et le coût de l'équipement, des simples récipients rincés aux boîtes à gants sophistiquées avec circulation et purification constantes du gaz.
Risques d'asphyxie
Une considération de sécurité critique est que les gaz inertes déplacent l'oxygène. Dans une zone mal ventilée, une fuite peut créer un environnement déficient en oxygène qui peut provoquer l'asphyxie. Une ventilation adéquate et une surveillance de l'oxygène sont des mesures de sécurité essentielles.
Faire le bon choix pour votre objectif
La décision d'utiliser une atmosphère inerte est dictée par le résultat spécifique que vous devez atteindre.
- Si votre objectif principal est la conservation : Votre but est d'arrêter la dégradation en déplaçant l'oxygène et l'humidité, prévenant ainsi l'oxydation et la détérioration.
- Si votre objectif principal est la sécurité des processus : Votre but est d'éliminer le risque d'incendie ou d'explosion en retirant l'oxygène nécessaire à la combustion.
- Si votre objectif principal est la pureté du produit : Votre but est de créer un environnement ultra-propre, garantissant qu'aucun contaminant réactif ne puisse interférer avec un processus sensible comme la synthèse chimique ou la fabrication électronique.
En fin de compte, une atmosphère inerte est un outil puissant pour prendre le contrôle d'un environnement chimique afin d'obtenir un résultat précis et fiable.
Tableau récapitulatif :
| Aspect | Détail clé |
|---|---|
| Objectif | Prévenir les réactions indésirables (oxydation, contamination, combustion) |
| Gaz courants | Azote (N₂), Argon (Ar) |
| Applications clés | Conservation des aliments, synthèse chimique, soudage, fabrication électronique |
| Principal avantage | Contrôle précis des processus chimiques et de l'intégrité des matériaux |
Besoin de créer un environnement contrôlé et inerte pour vos processus de laboratoire ? KINTEK est spécialisé dans la fourniture de l'équipement de laboratoire et des consommables précis nécessaires à vos applications, de la synthèse chimique à la recherche sur les matériaux. Notre expertise garantit que vos processus sont sûrs, purs et fiables. Contactez-nous dès aujourd'hui pour discuter de vos besoins spécifiques et découvrir la solution adaptée à votre laboratoire.
Guide Visuel
Produits associés
- Four à atmosphère contrôlée de 1400℃ avec atmosphère d'azote et inerte
- Four à atmosphère contrôlée 1200℃ Four à atmosphère inerte d'azote
- Four à atmosphère contrôlée 1700℃ Four à atmosphère inerte d'azote
- Four à atmosphère d'hydrogène contrôlée à l'azote
- Four à tube de laboratoire à haute température de 1400℃ avec tube en alumine
Les gens demandent aussi
- L'azote peut-il être utilisé pour le brasage ? Conditions clés et applications expliquées
- Qu'est-ce qu'une atmosphère d'azote pour le recuit ? Obtenez un traitement thermique sans oxydation
- Quel est un exemple d'atmosphère inerte ? Découvrez le meilleur gaz pour votre procédé
- Le gaz azote peut-il être chauffé ? Exploitez la chaleur inerte pour la précision et la sécurité
- Quelles sont les fonctions de l'azote (N2) dans les atmosphères de four contrôlées ? Obtenez d'excellents résultats de traitement thermique.



















