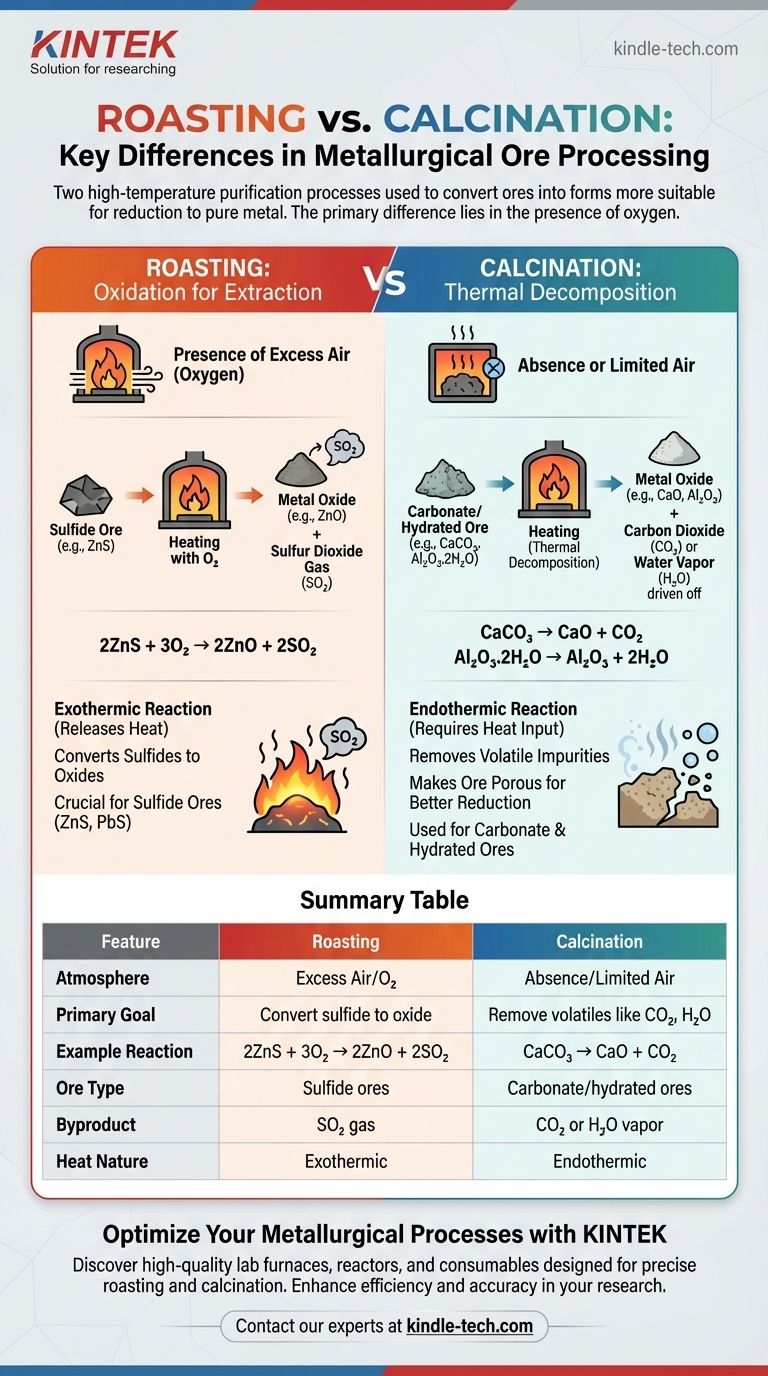
Fondamentalement, la principale différence entre la torréfaction et la calcination réside dans la présence d'oxygène. La torréfaction est le processus de chauffage d'un minerai concentré à haute température en présence d'un excès d'air. En revanche, la calcination consiste à chauffer un minerai à haute température soit en l'absence d'air, soit avec un apport très limité. Ces deux étapes sont des étapes préliminaires cruciales en métallurgie, conçues pour convertir les minerais en une forme plus adaptée à la réduction en métal pur.
Bien que les deux soient des processus de purification à haute température, la torréfaction utilise l'oxygène pour convertir chimiquement les minerais sulfurés en oxydes. La calcination, quant à elle, utilise la chaleur seule pour décomposer thermiquement les minerais carbonatés ou hydratés, chassant les substances volatiles comme le dioxyde de carbone et l'eau.

Comprendre la torréfaction : l'oxydation pour l'extraction
La torréfaction est un processus pyrométallurgique clé, ce qui signifie qu'elle utilise la chaleur pour provoquer des changements chimiques dans un minerai. Son application principale concerne les minerais sulfurés.
L'objectif fondamental
Le but principal de la torréfaction est de convertir un sulfure métallique en un oxyde métallique. Les oxydes métalliques sont nettement plus faciles et plus économiquement viables à réduire en métal pur que leurs homologues sulfurés.
La réaction chimique et l'exemple
Pendant la torréfaction, le minerai réagit avec l'oxygène de l'air. Cela convertit le sulfure métallique en oxyde métallique et produit du dioxyde de soufre (SO₂) comme sous-produit gazeux.
Un exemple classique est la torréfaction de la blende de zinc (ZnS) pour produire de l'oxyde de zinc (ZnO), une étape cruciale dans l'extraction du zinc :
2ZnS + 3O₂ → 2ZnO + 2SO₂
Caractéristiques clés de la torréfaction
Ce processus est effectué dans un four spécialisé, comme un four à réverbère ou un four à flamme, à une température inférieure au point de fusion du minerai. Pour de nombreux minerais sulfurés, la réaction est exothermique, ce qui signifie qu'elle dégage de la chaleur et peut se maintenir une fois commencée.
Comprendre la calcination : la décomposition thermique
La calcination est un autre processus de traitement thermique, mais son mécanisme chimique est entièrement différent. Elle est principalement utilisée pour les minerais carbonatés et hydratés.
L'objectif fondamental
L'objectif de la calcination est d'éliminer les impuretés volatiles en chauffant le minerai. Cela chasse des substances comme le dioxyde de carbone (des carbonates) ou l'eau (des oxydes hydratés), laissant derrière un oxyde métallique plus concentré.
La réaction chimique et l'exemple
La calcination est une réaction de décomposition thermique qui se produit en l'absence d'air. Un exemple principal est la calcination du calcaire (carbonate de calcium, CaCO₃) pour produire de la chaux (oxyde de calcium, CaO) :
CaCO₃ → CaO + CO₂
Une autre utilisation courante concerne les minerais hydratés, comme la bauxite (oxyde d'aluminium hydraté), pour éliminer l'eau avant le processus d'extraction de l'aluminium :
Al₂O₃.2H₂O → Al₂O₃ + 2H₂O
Caractéristiques clés de la calcination
Ce processus est endothermique, nécessitant un apport continu de chaleur. Il rend le minerai poreux, ce qui augmente la surface disponible pour l'étape de réduction ultérieure, augmentant ainsi son efficacité.
Comprendre les compromis et le contexte
Le choix entre ces processus n'est pas une question de préférence ; il est dicté par la chimie du minerai. Comprendre pourquoi est essentiel pour comprendre la métallurgie.
Pourquoi ne pas réduire directement les sulfures ?
La réduction directe des sulfures métalliques en métal est thermodynamiquement difficile et coûteuse. Les convertir d'abord en oxydes fournit une voie de réduction beaucoup plus efficace et économique, utilisant généralement le carbone (coke) comme agent réducteur.
Gestion des sous-produits
La torréfaction produit du dioxyde de soufre (SO₂), un gaz qui peut provoquer des pluies acides s'il est libéré dans l'atmosphère. Les usines métallurgiques modernes captent ce gaz et l'utilisent pour fabriquer de l'acide sulfurique, transformant un passif environnemental potentiel en un produit commercial de valeur.
L'importance d'un minerai poreux
La capacité de la calcination à créer un minerai poreux et friable est un avantage significatif. Cette surface accrue permet à l'agent réducteur (comme le monoxyde de carbone dans un haut fourneau) d'interagir plus efficacement avec l'oxyde métallique, accélérant l'extraction finale du métal.
Faire le bon choix pour votre minerai
Le choix entre la torréfaction et la calcination est entièrement dicté par la composition chimique du minerai que vous devez traiter.
- Si votre minerai est un sulfure (comme la blende de zinc, ZnS, ou la galène, PbS) : Vous devez utiliser la torréfaction pour convertir le sulfure en oxyde avant qu'il ne puisse être réduit en métal pur.
- Si votre minerai est un carbonate (comme la calamine, ZnCO₃, ou le calcaire, CaCO₃) : Vous devez utiliser la calcination pour le décomposer thermiquement et chasser le dioxyde de carbone, produisant l'oxyde métallique.
- Si votre minerai est un oxyde hydraté (comme la bauxite, Al₂O₃.2H₂O) : Vous devez utiliser la calcination pour éliminer l'eau chimiquement liée et produire un oxyde anhydre pur.
Comprendre cette distinction fondamentale est la première étape pour concevoir un processus d'extraction métallurgique efficace et efficient.
Tableau récapitulatif :
| Caractéristique | Torréfaction | Calcination |
|---|---|---|
| Atmosphère | Excès d'air (présence de O₂) | Absence ou air limité |
| Objectif principal | Convertir les minerais sulfurés en oxydes | Éliminer les impuretés volatiles (CO₂, H₂O) |
| Réaction type | 2ZnS + 3O₂ → 2ZnO + 2SO₂ | CaCO₃ → CaO + CO₂ |
| Type de minerai | Minerais sulfurés (ex. : ZnS, PbS) | Minerais carbonatés/hydratés (ex. : CaCO₃, bauxite) |
| Sous-produit | Gaz SO₂ | Vapeur de CO₂ ou H₂O |
| Nature de la chaleur | Exothermique (dégage de la chaleur) | Endothermique (nécessite un apport de chaleur) |
Optimisez vos processus métallurgiques avec KINTEK
Que vous traitiez des minerais sulfurés par torréfaction ou décomposiez des carbonates par calcination, disposer du bon équipement de laboratoire est crucial pour l'efficacité et la précision. KINTEK se spécialise dans la fourniture de fours de laboratoire, de réacteurs et de consommables de haute qualité conçus pour répondre aux exigences rigoureuses des essais et de la recherche métallurgiques.
Nos produits garantissent un contrôle précis de la température, un chauffage uniforme et une durabilité — des facteurs clés pour le succès des opérations de torréfaction et de calcination. En vous associant à KINTEK, vous avez accès à :
- Des équipements fiables qui améliorent la reproductibilité des processus
- Un support d'experts pour vous aider à choisir les bons outils pour votre type de minerai spécifique
- Des solutions qui améliorent la sécurité et la conformité environnementale
Prêt à affiner votre processus d'extraction ? Contactez nos experts dès aujourd'hui pour discuter de la manière dont l'équipement de laboratoire de KINTEK peut soutenir vos innovations métallurgiques et faire progresser votre recherche.
Guide Visuel
Produits associés
- Four tubulaire de traitement thermique rapide (RTP) de laboratoire
- Four à tube de laboratoire à haute température de 1700℃ avec tube en alumine
- Four de graphitisation de film de haute conductivité thermique sous vide de graphite
- Four à moufle de 1700℃ pour laboratoire
- Four de traitement thermique sous vide avec revêtement en fibre céramique
Les gens demandent aussi
- Comment un four tubulaire industriel garantit-il les conditions de processus requises pour les dispositifs expérimentaux à fluide supercritique ?
- Que se passe-t-il lorsque le quartz est chauffé ? Un guide de ses transitions de phase critiques et de ses utilisations
- Quel rôle joue un four à tube de quartz dans la synthèse du hBN ? Optimisez les résultats de votre dépôt chimique en phase vapeur
- Pourquoi utiliser des tubes de quartz et un scellage sous vide pour les électrolytes solides sulfurés ? Assurer la pureté et la stœchiométrie
- Quelle est la valeur technique de l'utilisation d'une chambre de réaction à tube de quartz pour les tests de corrosion statique ? Obtenir de la précision.



















