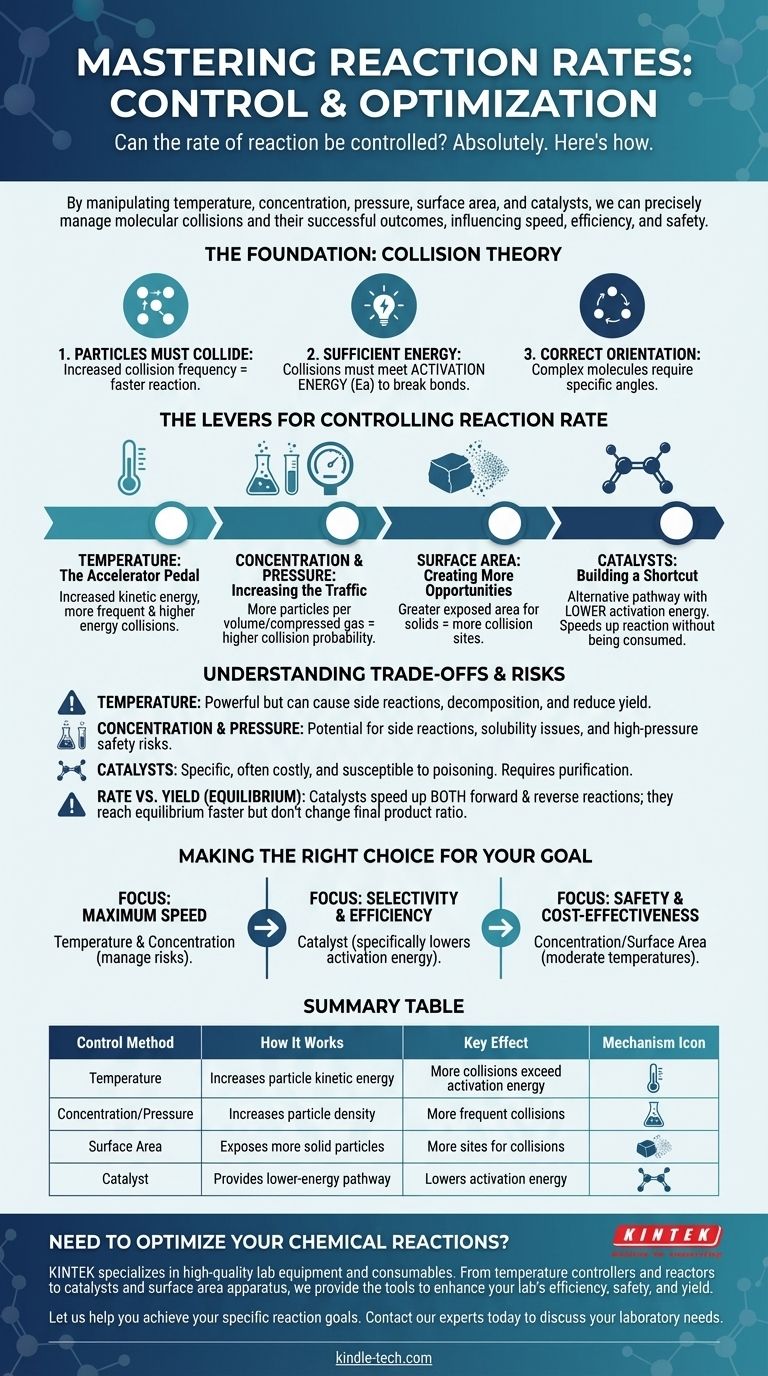
Absolument. Le taux d'une réaction chimique n'est pas une propriété fixe ; il peut être contrôlé avec précision. En manipulant des facteurs physiques et chimiques spécifiques, nous pouvons délibérément accélérer, ralentir ou même arrêter une réaction. Les principaux leviers de ce contrôle sont la température, la concentration des réactifs, la pression (pour les gaz), la surface (pour les solides) et l'introduction de catalyseurs.
Contrôler le taux d'une réaction revient fondamentalement à gérer la fréquence et l'énergie des collisions moléculaires. Chaque méthode, du chauffage d'une substance à l'ajout d'un catalyseur, fonctionne en influençant la fréquence des collisions entre les particules et si ces collisions sont fructueuses.

Le fondement : la théorie des collisions
Pour contrôler une réaction, vous devez d'abord comprendre ce qui la provoque. Le taux de toute réaction est régi par les principes de la théorie des collisions, qui stipule que trois conditions doivent être remplies pour qu'une réaction se produise.
1. Les particules doivent entrer en collision
Pour que deux molécules ou plus réagissent, elles doivent d'abord entrer en contact physique. Plus les particules entrent fréquemment en collision, plus elles ont d'occasions de réagir, ce qui augmente le taux de réaction.
2. Les collisions doivent avoir une énergie suffisante
Le simple fait d'entrer en collision ne suffit pas. Les particules qui entrent en collision doivent posséder une énergie cinétique minimale combinée, connue sous le nom d'énergie d'activation (Ea). Cette énergie est nécessaire pour rompre les liaisons chimiques existantes afin que de nouvelles puissent se former.
Les collisions dont l'énergie est inférieure à l'énergie d'activation seront infructueuses ; les particules rebondiront simplement les unes sur les autres sans changer.
3. Les particules doivent avoir l'orientation correcte
Pour les molécules complexes, la collision doit également se produire selon un angle ou une orientation spécifique. Si les parties réactives des molécules ne s'alignent pas correctement pendant la collision, aucune réaction ne se produira, même si l'exigence énergétique est satisfaite.
Les leviers pour contrôler le taux de réaction
Comprendre la théorie des collisions nous donne une feuille de route claire pour manipuler la vitesse de réaction. Chaque méthode de contrôle fonctionne en modifiant une ou plusieurs des conditions requises pour une collision réussie.
Température : La pédale d'accélérateur
Augmenter la température augmente l'énergie cinétique moyenne des particules. Cela a un effet puissant et double.
Premièrement, cela fait bouger les particules plus rapidement, entraînant des collisions plus fréquentes. Deuxièmement, et c'est le plus important, cela signifie qu'une fraction beaucoup plus importante de ces collisions aura une énergie égale ou supérieure à l'énergie d'activation, augmentant considérablement le taux de réactions réussies.
Concentration et pression : Augmenter le trafic
Augmenter la concentration des réactifs dans une solution signifie qu'il y a plus de particules concentrées dans le même volume. Cela augmente directement la probabilité de collision, augmentant ainsi le taux de réaction.
Pour les gaz, l'augmentation de la pression a le même effet. Elle force les molécules de gaz à se rapprocher, augmentant efficacement leur concentration et entraînant des collisions plus fréquentes.
Surface : Créer plus d'opportunités
Ce facteur est essentiel lorsqu'un solide réagit avec un liquide ou un gaz. En divisant un solide en morceaux plus petits (par exemple, d'un bloc solide à une poudre), vous augmentez considérablement sa surface totale.
Cela expose davantage de particules du solide à l'autre réactif, créant beaucoup plus de sites où les collisions peuvent se produire et augmentant le taux de réaction global.
Catalyseurs : Construire un raccourci
Un catalyseur est une substance qui augmente le taux de réaction sans être consommée dans le processus. Il fonctionne en fournissant une voie de réaction alternative avec une énergie d'activation plus faible.
Un catalyseur ne fait pas en sorte que les particules entrent en collision plus souvent ou avec plus d'énergie. Au lieu de cela, il abaisse la « barrière » énergétique qu'une collision doit franchir pour réussir, rendant beaucoup plus facile le déroulement d'une réaction.
Comprendre les compromis et les risques
Bien que ces leviers soient efficaces, ils ne sont pas sans conséquences. Choisir la bonne méthode nécessite de comprendre leurs limites et leurs inconvénients potentiels.
La force brute de la température
La chaleur est un outil puissant mais indiscriminé. Bien qu'elle accélère votre réaction souhaitée, elle accélérera également toute réaction secondaire potentielle. À des températures très élevées, elle peut même provoquer la décomposition des réactifs ou des produits, diminuant votre rendement global.
Les dangers de la concentration et de la pression
Des concentrations élevées peuvent parfois entraîner des réactions secondaires indésirables ou des problèmes de solubilité. Plus important encore, fonctionner à des pressions très élevées nécessite un équipement spécialisé, coûteux et robuste pour gérer les risques de sécurité importants liés à une défaillance potentielle du confinement.
La spécificité et le coût des catalyseurs
Les catalyseurs sont souvent très spécifiques et peuvent être très coûteux (par exemple, ceux utilisant le platine ou le palladium). Ils peuvent également être rendus inutiles par des impuretés, un processus connu sous le nom d'empoisonnement du catalyseur, qui nécessite une purification minutieuse des réactifs.
Taux par rapport au rendement (Équilibre)
Il est crucial de distinguer le taux de réaction du rendement de la réaction. Pour les réactions réversibles, qui peuvent se dérouler dans les deux sens (direct et inverse), un catalyseur accélère les deux réactions de manière égale. Cela signifie que vous atteindrez l'équilibre plus rapidement, mais cela ne modifiera pas le rapport final des produits aux réactifs.
Faire le bon choix pour votre objectif
La stratégie optimale pour contrôler une réaction dépend entièrement de votre objectif spécifique, qu'il s'agisse de vitesse, d'efficacité ou de sécurité.
- Si votre objectif principal est la vitesse maximale : L'augmentation de la température et de la concentration sont vos outils les plus directs, mais vous devez gérer activement les risques de réactions secondaires et de dangers pour la sécurité.
- Si votre objectif principal est la sélectivité et l'efficacité : Un catalyseur est souvent le meilleur choix, car il peut abaisser spécifiquement l'énergie d'activation pour la réaction souhaitée sans en favoriser d'autres.
- Si votre objectif principal est la sécurité et la rentabilité : La manipulation de la concentration ou de la surface à des températures modérées sont souvent les méthodes les plus accessibles et présentant le moins de risques.
La maîtrise de ces facteurs vous permet de transformer les réactions chimiques d'événements fixes en processus dynamiques pouvant être dirigés avec précision pour atteindre un résultat spécifique.
Tableau récapitulatif :
| Méthode de contrôle | Comment cela fonctionne | Effet clé |
|---|---|---|
| Température | Augmente l'énergie cinétique des particules | Plus de collisions dépassent l'énergie d'activation |
| Concentration/Pression | Augmente la densité des particules | Collisions plus fréquentes |
| Surface | Expose plus de particules de réactif solide | Plus de sites pour les collisions |
| Catalyseur | Fournit une voie de réaction à énergie plus faible | Abaisse l'énergie d'activation |
Besoin d'optimiser vos réactions chimiques ?
Le contrôle précis des taux de réaction est essentiel pour un travail de laboratoire réussi. Que vous ayez besoin d'accélérer une synthèse, d'améliorer la sélectivité ou d'assurer un fonctionnement sûr, l'équipement adéquat est indispensable.
KINTEK se spécialise dans la fourniture d'équipements et de consommables de laboratoire de haute qualité pour vous aider à maîtriser ces variables. Des contrôleurs de température de précision et des réacteurs pour gérer la chaleur et la pression à une large gamme de catalyseurs et d'appareils conçus pour une interaction de surface optimale, nous avons les outils pour améliorer l'efficacité, la sécurité et le rendement de votre laboratoire.
Laissez-nous vous aider à atteindre vos objectifs de réaction spécifiques. Contactez nos experts dès aujourd'hui pour discuter de vos besoins en laboratoire et trouver la solution parfaite.
Guide Visuel
Produits associés
- Réacteurs haute pression personnalisables pour des applications scientifiques et industrielles avancées
- Réacteurs de laboratoire personnalisables à haute température et haute pression pour diverses applications scientifiques
- Mini réacteur autoclave haute pression SS pour utilisation en laboratoire
- Réacteur Autoclave de Laboratoire Haute Pression pour Synthèse Hydrothermale
- Presse isostatique à chaud WIP Station de travail 300 MPa pour applications haute pression
Les gens demandent aussi
- Quelle est la fonction d'un réacteur hydrothermique à température constante ? Maîtriser l'activation des cendres volantes de charbon
- Quel est le rôle des réacteurs à haute pression dans l'étude de l'oxydation des alliages ? Des outils essentiels pour la recherche en conditions supercritiques
- Pourquoi les récipients de réaction de laboratoire scellés sont-ils nécessaires dans la synthèse hydrothermale des zéolithes ? Assurer la pureté et le rendement
- Comment un réacteur à haute pression démontre-t-il sa valeur dans le vieillissement accéléré ? Prédiction rapide de la durabilité des catalyseurs
- Pourquoi les autoclaves à haute pression sont-ils essentiels pour la préparation d'agents de durcissement à base de polyamide biosourcé à partir d'acide dimère ?



















