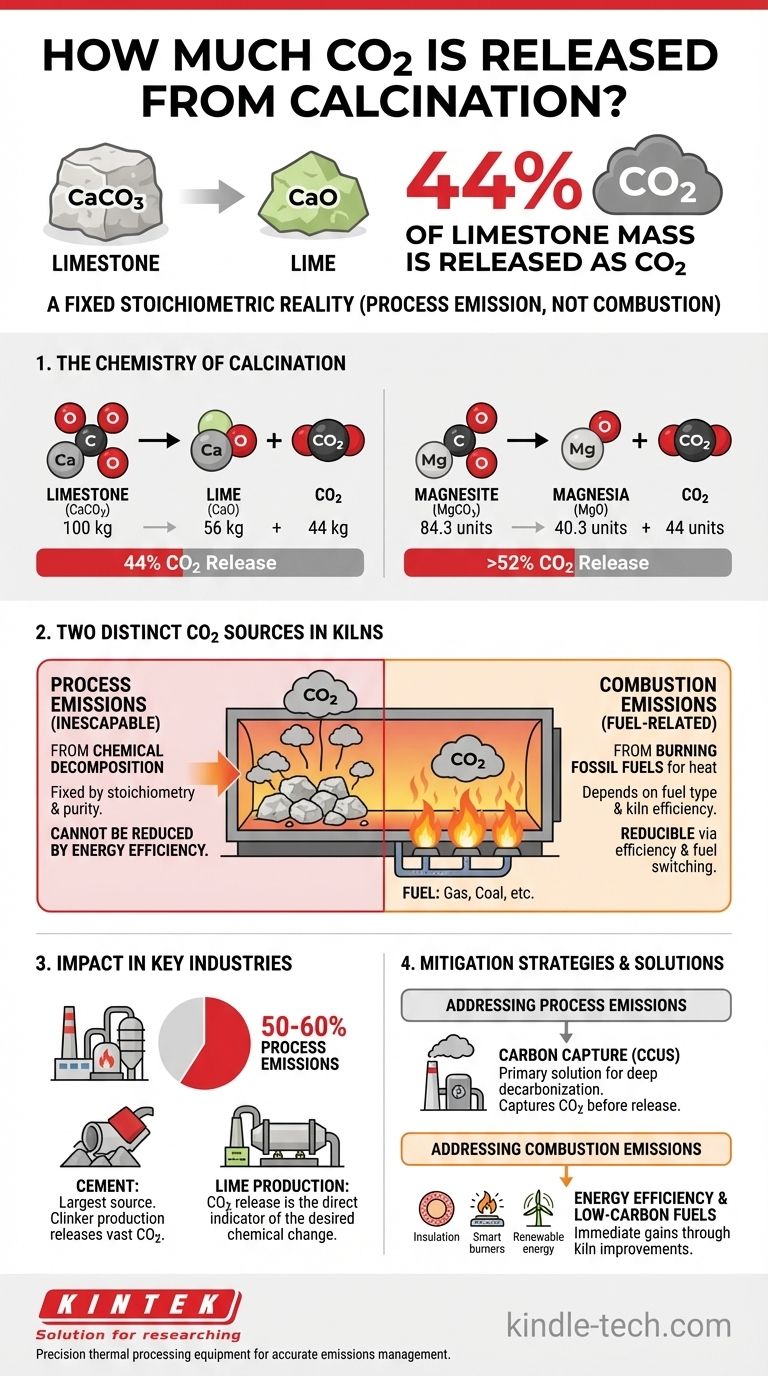
La calcination du calcaire (carbonate de calcium) libère 44 % de sa masse sous forme de dioxyde de carbone. Pour chaque 1 000 kg de carbonate de calcium pur traité, 440 kg de CO2 sont inévitablement libérés à la suite directe de la transformation chimique.
Le principe fondamental à comprendre est que le CO2 libéré pendant la calcination est une émission de procédé, et non une émission de combustion. Il est libéré directement de la structure chimique de la matière première, ce qui en fait une partie inéluctable de la réaction, indépendamment du combustible utilisé pour le chauffage.

La chimie de la calcination : une réalité stœchiométrique
La calcination est un processus de décomposition thermique. Lorsque certains matériaux, en particulier les carbonates, sont chauffés à haute température, ils se décomposent en un nouvel solide (généralement un oxyde) et libèrent un gaz.
Carbonate de calcium (Calcaire)
L'exemple industriel le plus courant est la calcination du calcaire (CaCO3) pour produire de la chaux (CaO).
L'équation chimique équilibrée est : CaCO3 → CaO + CO2
En examinant les masses atomiques (Ca≈40, C≈12, O≈16), nous pouvons voir que 100 unités de CaCO3 se décomposent en 56 unités de CaO et 44 unités de CO2. Ce rapport massique de 44 % est un fait chimique fixe.
Carbonate de magnésium (Magnésite)
Une réaction similaire se produit pour le carbonate de magnésium (MgCO3), qui est calciné pour produire de la magnésie (MgO).
L'équation est : MgCO3 → MgO + CO2
Ici, environ 84,3 unités de MgCO3 se décomposent en 40,3 unités de MgO et 44 unités de CO2. Cela signifie que pour la magnésite, plus de 52 % de la masse initiale est libérée sous forme de CO2.
La source du dioxyde de carbone
Il est essentiel de reconnaître que ce CO2 était chimiquement emprisonné dans la pierre elle-même. La chaleur élevée fournit simplement l'énergie nécessaire pour rompre les liaisons chimiques et libérer le gaz qui était déjà présent dans la structure moléculaire du matériau.
Émissions de procédé contre émissions de combustion
Dans tout four industriel réel, il existe deux sources distinctes de CO2, et ne pas les différencier entraîne une confusion importante dans la gestion des émissions.
Émissions de procédé (Le CO2 inéluctable)
Il s'agit du CO2 libéré par la décomposition chimique de la charge carbonatée, comme décrit ci-dessus. Il est entièrement déterminé par la stœchiométrie de la réaction et la pureté de la matière première.
Émissions de combustion (Le CO2 lié au combustible)
Il s'agit du CO2 généré par la combustion de combustibles fossiles (comme le gaz naturel, le charbon ou le coke de pétrole) pour atteindre les températures élevées (souvent >900°C) requises pour la calcination. Cette partie des émissions dépend du type de combustible et de l'efficacité thermique du four.
Pourquoi cette distinction est cruciale
Vous pouvez réduire les émissions de combustion en améliorant l'isolation du four, en utilisant des brûleurs plus efficaces ou en passant à des combustibles à faible teneur en carbone. Cependant, vous ne pouvez pas réduire les émissions de procédé par l'efficacité énergétique. Le CO2 provenant de la pierre sera libéré, que vous la chauffiez au gaz naturel, à l'électricité ou à l'énergie solaire concentrée.
L'impact de la calcination dans les industries clés
La libération stœchiométrique de CO2 fait de la calcination un objectif majeur des efforts de décarbonation industrielle.
L'industrie du ciment
La fabrication du ciment est la plus grande source unique d'émissions de calcination au monde. La production de clinker, l'ingrédient clé du ciment, implique la calcination d'énormes quantités de calcaire.
Les émissions de procédé dues à la calcination représentent 50 à 60 % de l'empreinte CO2 totale des cimenteries modernes. Le reste provient de la combustion des combustibles.
Production de chaux
L'objectif même d'un four à chaux est de produire du CaO à partir de CaCO3. Par conséquent, la libération de CO2 n'est pas seulement un sous-produit, mais un indicateur direct que la transformation chimique souhaitée a eu lieu.
Pièges courants et stratégies d'atténuation
Comprendre la nature des émissions de calcination est essentiel pour élaborer des stratégies efficaces pour les gérer.
Le piège de l'inefficacité
Une erreur courante est de croire que rendre un four plus économe en énergie éliminera ses émissions de CO2. Bien qu'il s'agisse d'une étape critique pour réduire les émissions de combustion, cela n'a absolument aucun effet sur l'arrêt des émissions de procédé.
Le rôle de la capture du carbone
Étant donné que les émissions de procédé sont chimiquement inévitables, la principale solution technologique pour une décarbonation profonde dans des secteurs comme le ciment et la chaux est la Capture, Utilisation et Stockage du Carbone (CCUS). Cette technologie capture le CO2 des gaz de combustion avant qu'il n'atteigne l'atmosphère.
Matériaux alternatifs
La recherche à long terme se concentre sur le développement de matériaux de construction alternatifs qui ne dépendent pas de la calcination des carbonates, éliminant ainsi le problème dès la conception du processus.
Comment quantifier le CO2 pour votre procédé
Votre approche pour mesurer et gérer le CO2 dépendra de votre objectif spécifique. Utilisez les principes de la stœchiométrie comme base.
- Si votre objectif principal est un rapport d'émissions précis : Vous devez calculer les émissions de procédé en fonction de la masse et de la composition chimique de votre charge carbonatée, puis calculer séparément les émissions de combustion en fonction des données de consommation de combustible.
- Si votre objectif principal est la réduction des émissions : Ciblez d'abord les émissions de combustion grâce à l'efficacité énergétique et au changement de combustible pour des gains immédiats, tout en évaluant la capture du carbone comme solution à long terme pour les émissions de procédé inévitables.
- Si votre objectif principal est la conception du procédé et le bilan matière : Tenez compte de la perte de masse importante (44 % pour le calcaire pur) de votre matière première solide lorsqu'elle se transforme en gaz, car cela aura un impact fondamental sur les flux de matériaux et les calculs de rendement du produit.
Comprendre la nature fixe et stœchiométrique des émissions de calcination est la première et la plus critique étape vers la gestion de l'empreinte carbone de ces processus industriels essentiels.
Tableau récapitulatif :
| Matériau | Réaction chimique | CO2 approximativement libéré (en masse) |
|---|---|---|
| Calcaire (CaCO3) | CaCO3 → CaO + CO2 | 44 % |
| Magnésite (MgCO3) | MgCO3 → MgO + CO2 | >52 % |
Besoin d'équipements de traitement thermique précis pour gérer votre processus de calcination et ses émissions ? KINTEK est spécialisé dans les fours de laboratoire et les fours industriels haute performance conçus pour un contrôle précis de la température et l'efficacité des processus. Que vous soyez en R&D, dans la production de ciment ou de chaux, nos équipements vous aident à obtenir des résultats optimaux tout en fournissant les données nécessaires à une comptabilité précise des émissions. Contactez nos experts dès aujourd'hui pour discuter de la manière dont nos solutions peuvent soutenir vos objectifs spécifiques de calcination et de décarbonation.
Guide Visuel
Produits associés
- Four rotatif à vide de laboratoire Four rotatif à tube
- Four de régénération électrique pour charbon actif à four rotatif
- Four rotatif continu scellé sous vide Four rotatif
- Four tubulaire de traitement thermique rapide (RTP) de laboratoire
- Four à moufle de laboratoire à moufle à levage par le bas
Les gens demandent aussi
- Quelle est la fonction principale d'un four tubulaire rotatif industriel ? Réduction à l'hydrogène de la poudre de tungstène
- Quel est le processus de production du zirconium ? Du minerai au métal et à la céramique haute performance
- Qu'est-ce que la méthode de dépôt chimique en phase vapeur modifiée ? Le procédé "de l'intérieur vers l'extérieur" pour les fibres optiques ultra-pures
- Quels sont les avantages de l'utilisation d'un four tubulaire rotatif pour les catalyseurs MoVOx ? Amélioration de l'uniformité et de la cristallinité
- Quel est le but du prétraitement des échantillons de charbon ? Assurer une pyrolyse précise grâce au séchage à l'azote



















