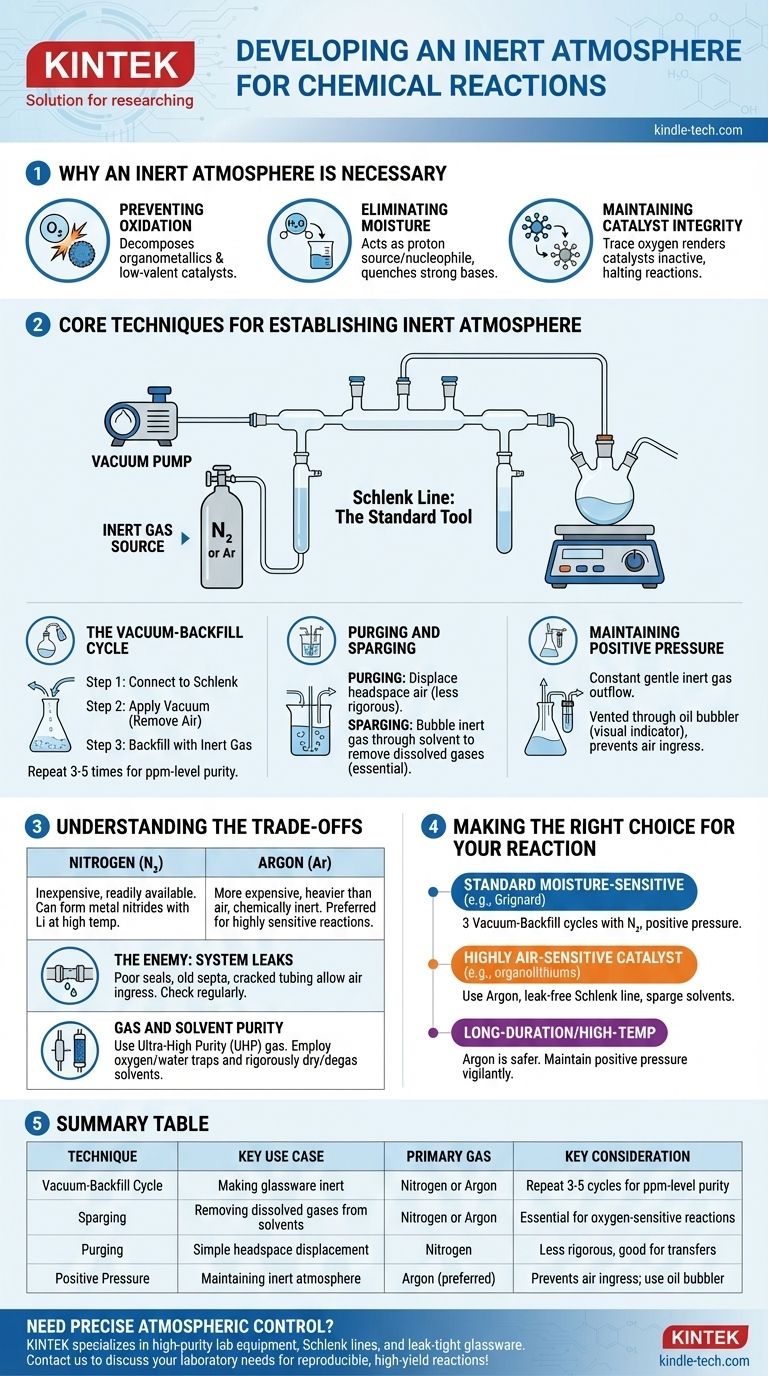
En pratique, une atmosphère inerte est créée en retirant physiquement l'air réactif d'un récipient de réaction et en le remplaçant par un gaz non réactif, le plus souvent de l'azote ou de l'argon. Ceci est généralement réalisé à l'aide d'un système à double collecteur appelé ligne de Schlenk, qui permet à un chimiste d'alterner entre l'application d'un vide au récipient et son remplissage avec le gaz inerte. Ce cycle est répété plusieurs fois pour s'assurer que tout l'oxygène et l'humidité sont éliminés.
L'objectif principal n'est pas simplement d'ajouter un gaz inerte, mais de déplacer et d'éliminer rigoureusement l'atmosphère réactive déjà présente. Maîtriser ce contrôle de l'environnement de réaction est fondamental pour prévenir les réactions secondaires indésirables et assurer l'intégrité des matériaux sensibles.

Pourquoi une atmosphère inerte est nécessaire
De nombreuses réactions chimiques impliquent des réactifs ou produisent des produits sensibles aux composants de l'air ambiant. Ne pas contrôler l'atmosphère peut entraîner des réactions ratées, de faibles rendements ou la formation de sous-produits dangereux.
Prévenir l'oxydation
Le coupable le plus courant est l'**oxygène moléculaire (O₂) **, un puissant agent oxydant. Il peut facilement réagir avec et décomposer de nombreux réactifs courants, en particulier les organométalliques, les catalyseurs métalliques de basse valence et les intermédiaires radicaux.
Éliminer l'humidité
La vapeur d'eau (H₂O) est une autre préoccupation majeure. Elle agit comme une source de protons (un acide faible) et un nucléophile, ce qui peut désactiver les bases fortes (comme les réactifs de Grignard ou les organolithiens) ou réagir avec des composés hautement électrophiles (comme les chlorures d'acyle).
Maintenir l'intégrité du catalyseur
En catalyse, l'état actif d'un catalyseur métallique est souvent un état d'oxydation spécifique et bas. L'exposition à des traces d'oxygène peut oxyder irréversiblement le catalyseur, le rendant inactif et arrêtant la réaction.
Techniques fondamentales pour établir une atmosphère inerte
L'outil standard pour ce processus est une ligne de Schlenk, un collecteur en verre connecté à la fois à une pompe à vide et à une source de gaz inerte de haute pureté. Cette configuration permet deux techniques principales.
Le cycle vide-remplissage
C'est la méthode la plus courante pour rendre la verrerie inerte.
- Le ballon de réaction vide et sec est connecté à la ligne de Schlenk.
- Un vide est appliqué, éliminant la majeure partie de l'air du ballon.
- Le vide est fermé et la vanne de gaz inerte est ouverte, remplissant le ballon d'azote ou d'argon jusqu'à la pression ambiante.
Ce cycle est généralement répété trois à cinq fois pour réduire la concentration d'oxygène et d'humidité à des niveaux négligeables (parties par million).
Purge et barbotage
La purge consiste simplement à faire passer un flux constant de gaz inerte à travers l'espace de tête du ballon pour déplacer l'air. C'est une méthode moins rigoureuse mais qui peut être utile pour des transferts simples.
Le barbotage est le processus de bullage du gaz inerte à travers un liquide (comme un solvant de réaction) via une longue aiguille ou un tube. Ceci est essentiel pour éliminer les gaz dissous, en particulier l'oxygène, du solvant avant le début de la réaction.
Maintien d'une pression positive
Une fois l'atmosphère inerte établie, une légère pression positive du gaz inerte est maintenue tout au long de l'expérience. Cela assure un écoulement constant et doux de gaz, empêchant tout air de s'infiltrer dans le système. Cet écoulement est généralement évacué par un barboteur à huile ou à mercure, qui sert également d'indicateur visuel du débit de gaz.
Comprendre les compromis
Choisir le bon gaz et être conscient des limitations du système sont essentiels pour réussir. Bien que ces techniques soient puissantes, elles ne sont pas infaillibles.
Azote vs. Argon
L'azote (N₂) est le gaz de travail pour la plupart des chimies en atmosphère inerte. Il est peu coûteux et facilement disponible. Cependant, dans certaines conditions (par exemple, réactions avec du lithium métallique à haute température), il peut être réactif, formant des nitrures métalliques.
L'argon (Ar) est nettement plus cher mais est plus lourd que l'air et chimiquement inerte dans pratiquement toutes les conditions de laboratoire. C'est le gaz de choix pour les réactions très sensibles ou celles impliquant des métaux qui peuvent réagir avec le N₂.
L'ennemi : les fuites du système
L'efficacité de votre atmosphère inerte ne dépend que de l'étanchéité la plus faible de votre installation. Des joints en verre mal graissés, de vieux septa en caoutchouc ou des tubes fissurés peuvent permettre à l'air de s'infiltrer lentement dans le système, compromettant la réaction. La vérification régulière des fuites avec un manomètre à vide est une pratique courante.
Pureté du gaz et du solvant
Utiliser simplement une bouteille de gaz inerte ne suffit pas. Pour les travaux extrêmement sensibles, un gaz de très haute pureté (UHP) est requis. De plus, des pièges à oxygène ou à eau peuvent être placés en ligne pour "nettoyer" les dernières traces de contaminants du gaz avant qu'il n'entre dans le collecteur. De même, les solvants doivent être rigoureusement séchés et dégazés (souvent par barbotage) avant utilisation.
Faire le bon choix pour votre réaction
Votre approche spécifique doit être adaptée à la sensibilité de vos réactifs et à l'objectif de votre expérience.
- Si votre objectif principal est une réaction standard sensible à l'humidité (par exemple, Grignard) : Effectuer trois cycles vide-remplissage avec de l'azote et maintenir une pression positive est généralement suffisant.
- Si votre objectif principal est une réaction utilisant un catalyseur ou un réactif très sensible à l'air (par exemple, organolithiens, nickel de basse valence) : L'utilisation d'argon, l'assurance d'une ligne de Schlenk sans fuite et le barbotage de vos solvants sont essentiels pour réussir.
- Si votre objectif principal est une réaction de longue durée ou à haute température : L'argon est le choix le plus sûr pour éviter les réactions secondaires potentielles avec l'azote, et vous devez rester vigilant quant au maintien d'une pression positive pendant toute la durée de la réaction.
La maîtrise de ces techniques de contrôle atmosphérique vous donne une véritable maîtrise de l'environnement chimique, transformant une réaction d'une question de hasard en un processus prévisible et reproductible.
Tableau récapitulatif :
| Technique | Cas d'utilisation clé | Gaz principal | Considération clé |
|---|---|---|---|
| Cycle vide-remplissage | Rendre la verrerie inerte | Azote ou Argon | Répéter 3 à 5 cycles pour une pureté de l'ordre du ppm |
| Barbotage | Éliminer les gaz dissous des solvants | Azote ou Argon | Essentiel pour les réactions sensibles à l'oxygène |
| Purge | Simple déplacement de l'espace de tête | Azote | Moins rigoureux, bon pour les transferts |
| Pression positive | Maintenir l'atmosphère inerte | Argon (préféré) | Empêche l'entrée d'air ; utiliser un barboteur à huile |
Besoin d'un contrôle atmosphérique précis pour vos réactions sensibles ? KINTEK est spécialisé dans les équipements et consommables de laboratoire de haute pureté, y compris les lignes de Schlenk, les systèmes de purification de gaz et la verrerie étanche. Nos experts peuvent vous aider à choisir la bonne configuration pour prévenir l'oxydation, éliminer l'humidité et maintenir l'intégrité du catalyseur. Contactez-nous dès aujourd'hui pour discuter de vos besoins spécifiques en laboratoire et réaliser des réactions reproductibles et à haut rendement !
Guide Visuel
Produits associés
- Four à atmosphère contrôlée 1200℃ Four à atmosphère inerte d'azote
- Four à atmosphère contrôlée 1700℃ Four à atmosphère inerte d'azote
- Four à atmosphère contrôlée de 1400℃ avec atmosphère d'azote et inerte
- Four à atmosphère d'hydrogène contrôlée à l'azote
- Four à tube de laboratoire à haute température de 1400℃ avec tube en alumine
Les gens demandent aussi
- L'azote peut-il être utilisé pour le brasage ? Conditions clés et applications expliquées
- Pourquoi l'azote est-il utilisé dans un four ? Un bouclier rentable pour les processus à haute température
- Qu'est-ce qu'une atmosphère inerte ? Un guide pour prévenir les incendies et les explosions
- Quels gaz sont utilisés dans les atmosphères inertes ? Choisissez le bon gaz pour les environnements non réactifs
- Qu'est-ce qui fournit une atmosphère inerte ? Atteignez la sécurité et la pureté avec l'azote, l'argon ou le CO2



















