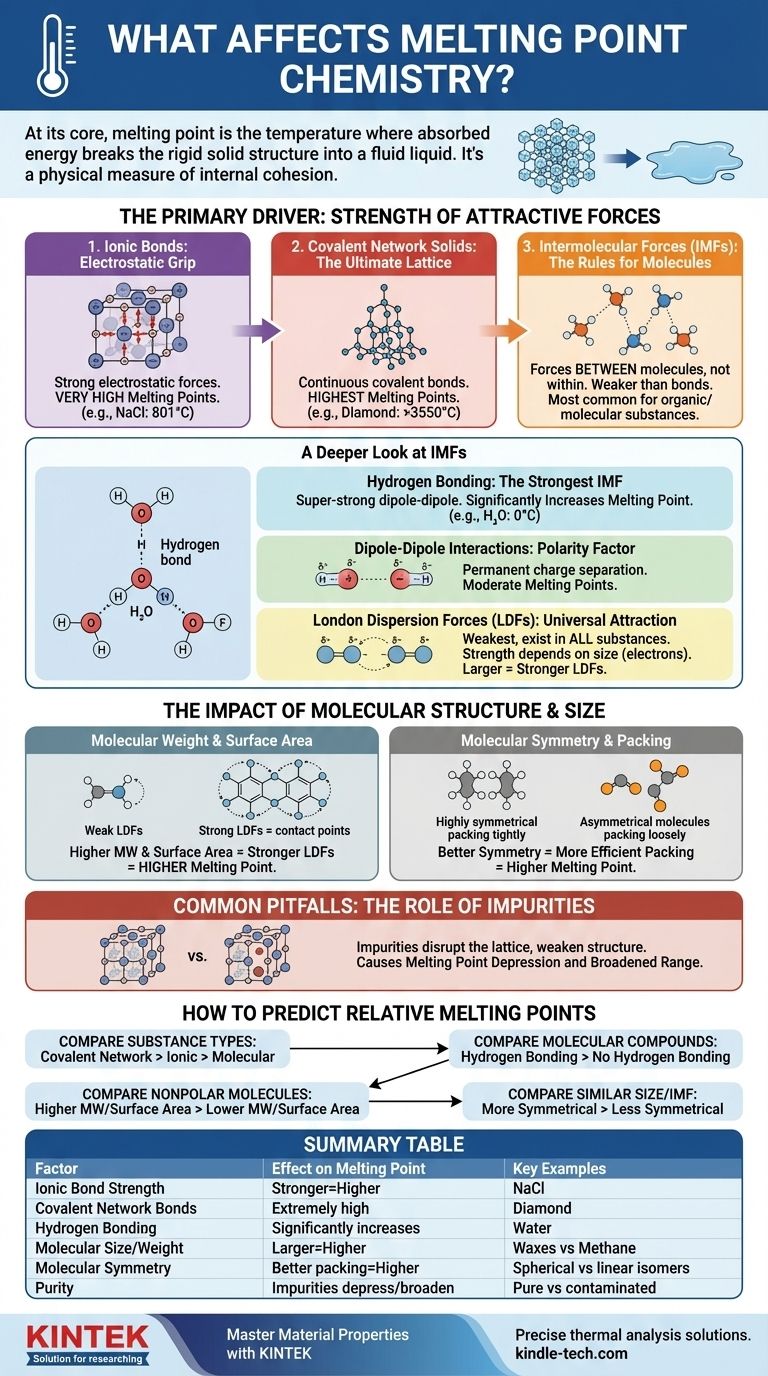
À la base, le point de fusion d'une substance est la température à laquelle elle a absorbé suffisamment d'énergie pour rompre la structure rigide et ordonnée d'un solide et passer à un liquide désordonné et fluide. Ceci est déterminé par deux facteurs principaux : la force des forces d'attraction qui maintiennent les particules (atomes, ions ou molécules) ensemble, et l'efficacité avec laquelle ces particules s'empilent dans un réseau cristallin solide.
Le point de fusion n'est pas juste un chiffre ; c'est une mesure physique de la cohésion interne d'une substance. Pour le comprendre, vous devez d'abord identifier la force dominante qui maintient les particules ensemble — qu'il s'agisse d'une puissante liaison ionique ou d'une faible attraction intermoléculaire — puis considérer comment la taille et la forme moléculaires affinent cette valeur.

Le moteur principal : la force des forces d'attraction
La quantité d'énergie nécessaire pour perturber un réseau cristallin solide est directement proportionnelle à la force des forces qui le maintiennent uni. Ces forces existent sur un vaste spectre, allant des liaisons chimiques incroyablement fortes aux forces intermoléculaires beaucoup plus faibles.
Liaisons ioniques : l'emprise électrostatique
Les composés ioniques, comme le sel de table (NaCl), sont maintenus ensemble par de puissantes attractions électrostatiques entre les ions positifs et négatifs. Ces forces créent un réseau cristallin très stable.
Surmonter ces fortes attractions nécessite une quantité énorme d'énergie thermique, c'est pourquoi les composés ioniques ont généralement des points de fusion très élevés.
Solides à réseau covalent : le réseau ultime
Dans un solide à réseau covalent, comme le diamant ou le quartz (SiO₂), les atomes ne sont pas seulement attirés les uns par les autres ; ils sont unis par un réseau continu de fortes liaisons covalentes. Il n'y a pas de molécules individuelles à séparer.
Pour faire fondre une telle substance, il faut commencer à rompre ces puissantes liaisons covalentes. Cela nécessite plus d'énergie que tout autre type d'interaction, ce qui confère à ces matériaux les points de fusion les plus élevés de toutes les substances.
Forces intermoléculaires (FIM) : les règles pour les molécules
Pour les composés moléculaires (comme l'eau, le sucre ou la cire), le point de fusion ne consiste pas à rompre les liaisons covalentes à l'intérieur des molécules. Il s'agit de surmonter les forces d'attraction plus faibles entre les molécules. Celles-ci sont connues sous le nom de forces intermoléculaires (FIM).
Un regard plus approfondi sur les forces intermoléculaires (FIM)
Le type et la force des FIM sont le facteur le plus important pour déterminer le point de fusion de la plupart des substances organiques et moléculaires. Elles sont généralement beaucoup plus faibles que les liaisons chimiques complètes.
La liaison hydrogène : la FIM la plus forte
Il s'agit d'un type spécial et super-fort d'interaction dipôle-dipôle qui se produit lorsque l'hydrogène est lié à un atome très électronégatif comme l'azote (N), l'oxygène (O) ou le fluor (F).
L'attraction résultante entre les molécules est significative. L'eau (H₂O) est un exemple classique ; ses liaisons hydrogène lui confèrent un point de fusion beaucoup plus élevé (0 °C) que ce à quoi on pourrait s'attendre pour une molécule de sa taille.
Interactions dipôle-dipôle : le facteur de polarité
Les molécules polaires ont une séparation de charge permanente, créant une extrémité positive et une extrémité négative, comme de minuscules aimants. Ces "pôles" moléculaires s'attirent mutuellement.
Ces forces sont plus fortes que les forces entre les molécules non polaires de taille similaire, ce qui entraîne des points de fusion modérés.
Forces de dispersion de London (FDL) : l'attraction universelle
Les FDL sont le type de FIM le plus faible et existent dans toutes les substances. Elles proviennent des fluctuations aléatoires et temporaires de la distribution électronique autour d'une molécule, ce qui crée des dipôles fugaces et instantanés.
La force des FDL dépend directement de la taille de la molécule (spécifiquement, de son nombre d'électrons). Les molécules plus grosses ont des nuages d'électrons plus grands et plus "flottants", ce qui les rend plus polarisables et conduit à des FDL plus fortes. C'est pourquoi les grosses molécules non polaires comme la cire peuvent toujours être solides à température ambiante.
L'impact de la structure et de la taille moléculaires
Au-delà du type de force, la forme et la taille spécifiques d'une molécule jouent un rôle crucial dans l'ajustement de son point de fusion.
Poids moléculaire et surface
Pour les molécules ayant la même FIM dominante (par exemple, en comparant deux molécules non polaires), celle ayant le poids moléculaire le plus élevé aura des FDL plus fortes et donc un point de fusion plus élevé. Une plus grande surface permet plus de points de contact entre les molécules, renforçant également les FDL.
Symétrie moléculaire et empilement
La symétrie a un effet profond. Les molécules hautement symétriques peuvent s'empiler de manière plus efficace et plus serrée dans un réseau cristallin stable, comme des briques LEGO bien faites.
Cet arrangement dense et ordonné nécessite plus d'énergie pour être brisé. Par conséquent, une molécule plus symétrique aura souvent un point de fusion nettement plus élevé qu'un isomère moins symétrique, même s'ils ont la même formule et le même poids.
Pièges courants à éviter : le rôle des impuretés
Dans un contexte pratique, l'un des facteurs les plus courants affectant le point de fusion est la pureté de l'échantillon.
Perturbation du réseau cristallin
Les impuretés sont des particules étrangères qui ne s'intègrent pas parfaitement dans le réseau cristallin de la substance. Elles introduisent des défauts et affaiblissent la structure globale.
Comme le réseau est déjà perturbé, il faut moins d'énergie pour le décomposer, ce qui entraîne un point de fusion plus bas. Ce phénomène est connu sous le nom d'abaissement du point de fusion.
Une plage de fusion élargie
Une substance pure fond généralement sur une plage de température très étroite (souvent inférieure à 1 °C). La présence d'impuretés abaisse non seulement le point de fusion, mais provoque également la fusion de la substance sur une plage de température plus large et plus étendue. Les chimistes utilisent cette caractéristique pour évaluer la pureté d'un composé synthétisé.
Comment prédire les points de fusion relatifs
Lors de la comparaison de deux substances, parcourez cette hiérarchie de questions pour faire une prédiction précise.
- Si votre objectif principal est de comparer différents types de substances : Un solide à réseau covalent (diamant) aura un point de fusion plus élevé qu'un composé ionique (sel), qui sera bien supérieur à celui d'un composé moléculaire (sucre).
- Si votre objectif principal est de comparer deux composés moléculaires : Vérifiez d'abord la présence de liaisons hydrogène. La molécule capable de former des liaisons hydrogène aura presque toujours un point de fusion plus élevé que celle qui ne le peut pas, en supposant une taille similaire.
- Si votre objectif principal est de comparer deux molécules non polaires : La molécule ayant le poids moléculaire le plus élevé et la plus grande surface aura des forces de dispersion de London plus fortes et un point de fusion plus élevé.
- Si votre objectif principal est de comparer deux molécules de taille et de type de FIM similaires : La molécule la plus symétrique qui peut s'empiler plus efficacement dans un réseau cristallin aura probablement le point de fusion le plus élevé.
Comprendre ces facteurs transforme le point de fusion d'un simple point de données en un indicateur puissant des forces moléculaires fondamentales et de la structure d'une substance.
Tableau récapitulatif :
| Facteur | Effet sur le point de fusion | Exemples clés |
|---|---|---|
| Force de la liaison ionique | Liaisons plus fortes = point de fusion plus élevé | Chlorure de sodium (NaCl) : 801°C |
| Liaisons du réseau covalent | Points de fusion extrêmement élevés | Diamant : >3550°C |
| Liaison hydrogène | Augmente considérablement le point de fusion | Eau (H₂O) : 0°C |
| Taille/Poids moléculaire | Molécules plus grosses = point de fusion plus élevé (FDL plus fortes) | Cires (poids moléculaire élevé) vs. Méthane (poids moléculaire faible) |
| Symétrie moléculaire | Meilleur empilement = point de fusion plus élevé | Isomères sphériques contre linéaires |
| Pureté | Les impuretés abaissent et élargissent la plage de fusion | Échantillons purs contre contaminés |
Maîtrisez les propriétés des matériaux avec KINTEK
Comprendre les points de fusion est essentiel pour la sélection des matériaux, la synthèse et le contrôle qualité en laboratoire. Que vous développiez de nouveaux composés ou analysiez la pureté des matériaux, disposer du bon équipement est indispensable.
KINTEK est spécialisée dans les équipements et consommables de laboratoire de haute qualité conçus pour fournir une analyse thermique précise et fiable. Nos produits aident les chercheurs et les professionnels de laboratoire à déterminer avec précision les points de fusion et à comprendre le comportement des matériaux.
Prêt à améliorer les capacités de votre laboratoire ? Contactez nos experts dès aujourd'hui pour trouver la solution parfaite pour vos besoins en analyse thermique.
Guide Visuel
Produits associés
- Four de traitement thermique sous vide et four de fusion par induction à lévitation
- Four de Fusion par Induction sous Vide à l'Échelle du Laboratoire
- Système de fusion par induction sous vide pour la fabrication de bandes et de fils
- Presse hydraulique chauffante avec plaques chauffantes manuelles intégrées pour utilisation en laboratoire
- Four de fusion à induction par arc sous vide non consommable
Les gens demandent aussi
- Qu'est-ce que la technique de chauffage par micro-ondes ? Un guide pour un traitement thermique rapide et uniforme
- Comment les diamants sont-ils utilisés à des fins industrielles ? Libérez des performances extrêmes avec les outils diamantés
- En quoi la torréfaction diffère-t-elle de la pyrolyse lente ? Choisissez le bon procédé de biomasse pour votre objectif
- Quel est le rôle du frittage ? Transformer la poudre en pièces durables et complexes
- Comment un dispositif d'agitation mécanique contribue-t-il à l'uniformité des revêtements d'oxyde dopé ? Améliorer la qualité des catalyseurs PEO
- Quels sont les paramètres de la pulvérisation cathodique ? Maîtrisez les 4 variables clés pour des films minces parfaits
- Quels sont les inconvénients du graphite ? Gérer la fragilité et la réactivité dans les applications à haute température
- Quelles améliorations un système d'agitation magnétique de précision apporte-t-il à l'électrodéposition de l'indium ? Augmentez l'efficacité dès maintenant





















