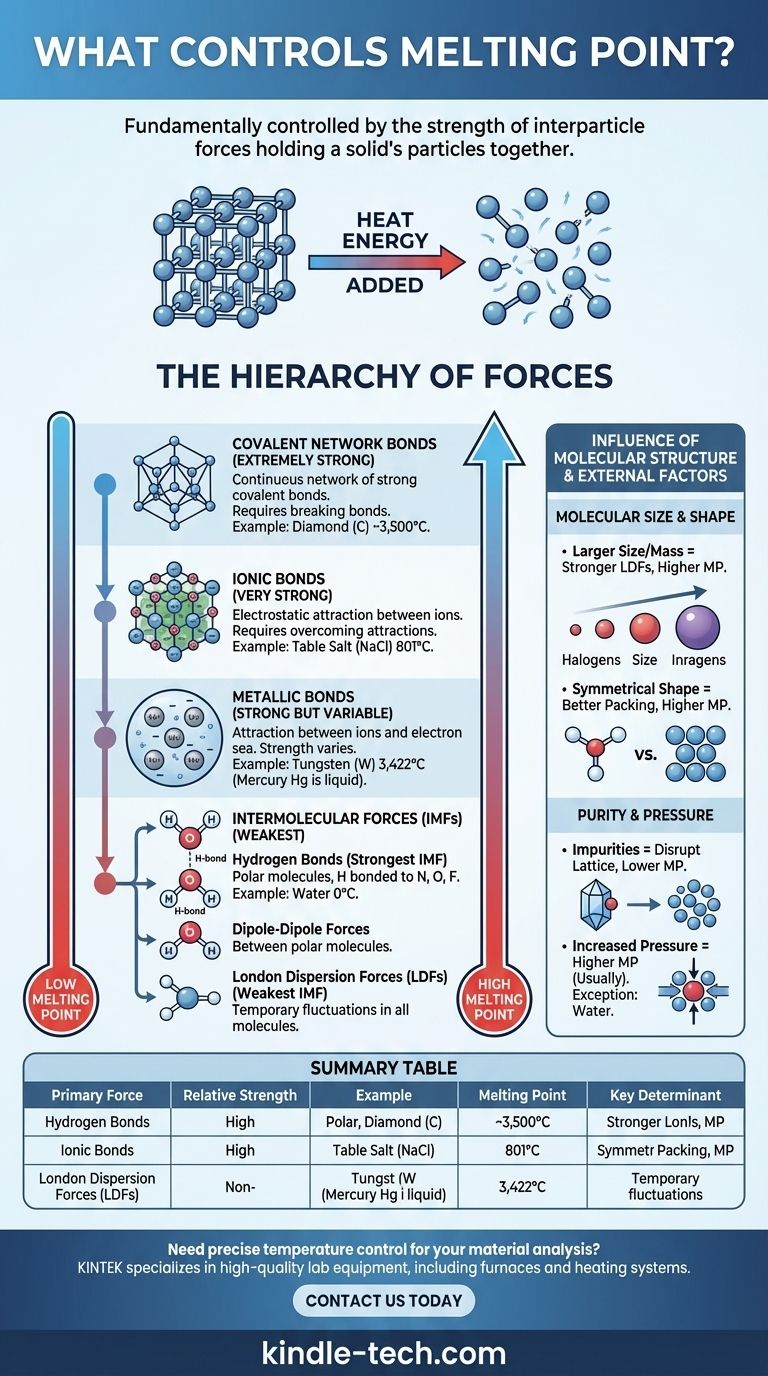
Le point de fusion d'une substance est fondamentalement contrôlé par la force des liaisons qui maintiennent ses particules ensemble. Dans un solide, les particules (atomes, ions ou molécules) sont enfermées dans un arrangement fixe et ordonné appelé réseau cristallin. Pour faire fondre le solide, il faut ajouter suffisamment d'énergie thermique pour permettre à ces particules de surmonter ces forces et de se déplacer les unes par rapport aux autres comme un liquide. Par conséquent, des forces plus fortes nécessitent plus d'énergie pour être rompues, ce qui entraîne un point de fusion plus élevé.
Le principe fondamental est simple : la fusion ne consiste pas à briser les particules elles-mêmes, mais à surmonter les forces d'attraction entre elles. Le type et la force de ces forces interparticulaires – allant des puissantes liaisons ioniques aux faibles attractions intermoléculaires – sont les principaux déterminants du point de fusion d'une substance.

La hiérarchie des forces
L'immense variation des points de fusion – de -259°C pour l'hydrogène à 3 422°C pour le tungstène – peut être comprise en classant les forces qui maintiennent un solide ensemble. Ces forces existent dans une hiérarchie claire de force.
Liaisons ioniques (très fortes)
Dans les composés ioniques comme le sel de table (NaCl), les particules sont des ions chargés positivement et négativement. Elles sont maintenues ensemble par de puissantes attractions électrostatiques dans un réseau cristallin rigide.
Surmonter ces fortes liaisons ioniques nécessite une énorme quantité d'énergie thermique. Par conséquent, les composés ioniques présentent systématiquement des points de fusion très élevés.
Liaisons covalentes en réseau (extrêmement fortes)
Dans les solides à réseau covalent, les atomes sont liés par un vaste réseau continu de fortes liaisons covalentes. Il n'y a pas de molécules individuelles ; le cristal entier est essentiellement une seule molécule géante.
Des substances comme le diamant (carbone) et le quartz (dioxyde de silicium) en sont de parfaits exemples. Pour les faire fondre, il faut briser ces liaisons covalentes extrêmement fortes, ce qui demande d'énormes quantités d'énergie, conduisant à des points de fusion exceptionnellement élevés.
Liaisons métalliques (fortes mais variables)
Les métaux sont constitués d'un réseau d'ions métalliques positifs baignant dans une "mer" d'électrons délocalisés qui se déplacent librement dans la structure. L'attraction entre les ions positifs et cette mer d'électrons constitue la liaison métallique.
La force de cette liaison, et donc le point de fusion, varie considérablement. Elle dépend de facteurs tels que la charge de l'ion et le nombre d'électrons délocalisés. C'est pourquoi le mercure est un liquide à température ambiante, tandis que le tungstène a l'un des points de fusion les plus élevés de tous les éléments.
Forces intermoléculaires (les plus faibles)
Pour les composés moléculaires (comme l'eau, le sucre ou la cire), les forces qui doivent être surmontées pour la fusion sont les forces intermoléculaires (FIM) – les attractions entre molécules séparées. Celles-ci sont significativement plus faibles que les liaisons ioniques, covalentes ou métalliques discutées ci-dessus.
Il existe trois principaux types de FIM :
- Liaisons hydrogène : Le type de FIM le plus fort. Il se produit dans les molécules polaires où l'hydrogène est directement lié à un atome très électronégatif (azote, oxygène ou fluor). Le point de fusion relativement élevé de l'eau (0°C) est dû à ces fortes liaisons hydrogène.
- Forces dipôle-dipôle : Se produisent entre des molécules polaires qui ont des extrémités positives et négatives permanentes. Ces forces sont plus faibles que les liaisons hydrogène.
- Forces de London (LDF) : La FIM la plus faible, présente dans toutes les molécules. Elles résultent de fluctuations temporaires et aléatoires de la distribution des électrons. Bien que faibles individuellement, leur effet cumulatif peut être significatif dans les molécules plus grandes.
L'influence de la structure moléculaire
Au-delà du type de force, la taille et la forme spécifiques des particules jouent un rôle critique, en particulier pour les composés moléculaires.
Taille et masse moléculaires
Pour les composés ayant la même force intermoléculaire primaire (par exemple, les LDF), les molécules plus grandes ont des points de fusion plus élevés. C'est parce que les molécules plus grandes ont plus d'électrons, créant un nuage électronique plus "polarisable" qui conduit à des forces de dispersion de London plus fortes.
Cette tendance est claire chez les halogènes : le point de fusion augmente à mesure que l'on passe du fluor (F₂) à l'iode (I₂).
Forme moléculaire et efficacité d'empaquetage
La capacité d'une molécule à s'empaqueter étroitement et efficacement dans un réseau cristallin a un impact majeur. Les molécules symétriques ont souvent des points de fusion plus élevés que les isomères moins symétriques, même si elles ont la même formule et la même masse.
Les formes symétriques permettent aux molécules de s'assembler plus étroitement à l'état solide, maximisant l'efficacité de leurs forces intermoléculaires. Briser cette structure bien organisée nécessite plus d'énergie.
Comprendre les compromis et les nuances
La prédiction des points de fusion implique de peser ces facteurs interconnectés.
La pureté change tout
Les principes ci-dessus supposent une substance pure. Les impuretés perturbent le réseau cristallin ordonné, affaiblissant la structure globale.
Cette perturbation rend le solide plus facile à faire fondre. En conséquence, une substance impure fondra à une température plus basse et sur une plage plus large que son homologue pur. Ce phénomène est connu sous le nom d'abaissement du point de fusion.
La pression joue un rôle
Les points de fusion sont généralement indiqués à pression atmosphérique standard. Pour la plupart des substances, l'augmentation de la pression élève le point de fusion car elle pousse physiquement les particules plus près les unes des autres, renforçant la structure du réseau.
L'eau est une exception célèbre et critique. Parce que la glace solide est moins dense que l'eau liquide, une pression accrue favorise la phase liquide plus dense, ce qui abaisse le point de fusion.
Comment appliquer cela à votre analyse
Lorsque vous comparez des substances, utilisez une approche systématique pour identifier les facteurs clés en jeu.
- Si votre objectif principal est de comparer différentes classes de solides : Identifiez d'abord la force de liaison primaire — ionique, réseau covalent, métallique ou intermoléculaire. Cela vous donnera l'indicateur le plus significatif du point de fusion relatif.
- Si votre objectif principal est de comparer deux composés moléculaires : Déterminez la force intermoléculaire la plus forte que chacun possède (liaisons hydrogène > dipôle-dipôle > LDF). Le composé avec la FIM la plus forte aura généralement un point de fusion plus élevé.
- Si votre objectif principal est de comparer des molécules non polaires similaires : La molécule avec la plus grande masse et surface aura des forces de dispersion de London plus fortes et donc un point de fusion plus élevé.
- Si votre objectif principal est de comparer des isomères (même formule, forme différente) : La molécule plus symétrique qui peut s'empaqueter plus efficacement dans un réseau cristallin aura souvent un point de fusion plus élevé.
En comprenant cette hiérarchie des forces et l'influence de la structure, vous pouvez expliquer systématiquement le comportement de fusion de presque toute substance.
Tableau récapitulatif :
| Type de force primaire | Force relative | Exemple de substance | Point de fusion | Déterminant clé |
|---|---|---|---|---|
| Réseau covalent | Extrêmement forte | Diamant (C) | ~3 500°C | Rupture des liaisons covalentes dans un réseau continu |
| Liaisons ioniques | Très forte | Chlorure de sodium (NaCl) | 801°C | Surmonter les attractions électrostatiques entre les ions |
| Liaisons métalliques | Forte (variable) | Tungstène (W) | 3 422°C | Force de l'attraction ion-mer d'électrons |
| Forces intermoléculaires | Les plus faibles | Eau (H₂O) | 0°C | Liaisons hydrogène, dipôle-dipôle, forces de London |
Besoin d'un contrôle précis de la température pour votre analyse de matériaux ? Comprendre les points de fusion est essentiel pour des résultats de laboratoire fiables. Chez KINTEK, nous sommes spécialisés dans les équipements de laboratoire de haute qualité, y compris les fours et les systèmes de chauffage conçus pour une analyse thermique précise. Que vous travailliez avec des métaux à point de fusion élevé ou des composés moléculaires sensibles, nos solutions garantissent des performances constantes. Contactez-nous dès aujourd'hui pour discuter de la manière dont nos produits peuvent améliorer les capacités de votre laboratoire et soutenir votre recherche. Contactez-nous via notre formulaire de contact pour commencer !
Guide Visuel
Produits associés
- Four à moufle de laboratoire à moufle à levage par le bas
- Four à moufle de 1800℃ pour laboratoire
- Four à moufle de four à étuve de 1400℃ pour laboratoire
- Four à moufle de 1700℃ pour laboratoire
- Four à tube de laboratoire à haute température de 1400℃ avec tube en alumine
Les gens demandent aussi
- Quelle est la règle du delta 20 pour l'évaporation ? Maîtriser la pulvérisation sûre et efficace
- Comment assurer la sécurité lors de l'utilisation d'un bain-marie ?Conseils essentiels pour la prévention des accidents
- Quel est le processus de l'agglomération (sintering) dans l'industrie sidérurgique ? Optimisez l'efficacité du haut fourneau avec une charge conçue sur mesure
- Comment un agitateur de laboratoire contribue-t-il à évaluer l'impact des nanoparticules d'oxyde de chrome sur les bactéries en culture liquide?
- Quels sont les avantages et les inconvénients du frittage laser ? Créez des pièces complexes et fonctionnelles
- À quelle température la pyrolyse conventionnelle est-elle effectuée ? Découvrez la bonne température pour le produit souhaité
- Quelles sont les applications de la technologie des films minces ? Alimenter l'électronique, l'énergie et l'innovation
- Qu'est-ce qui affecte la conductivité des matériaux ? Découvrez la science derrière la performance électrique



















