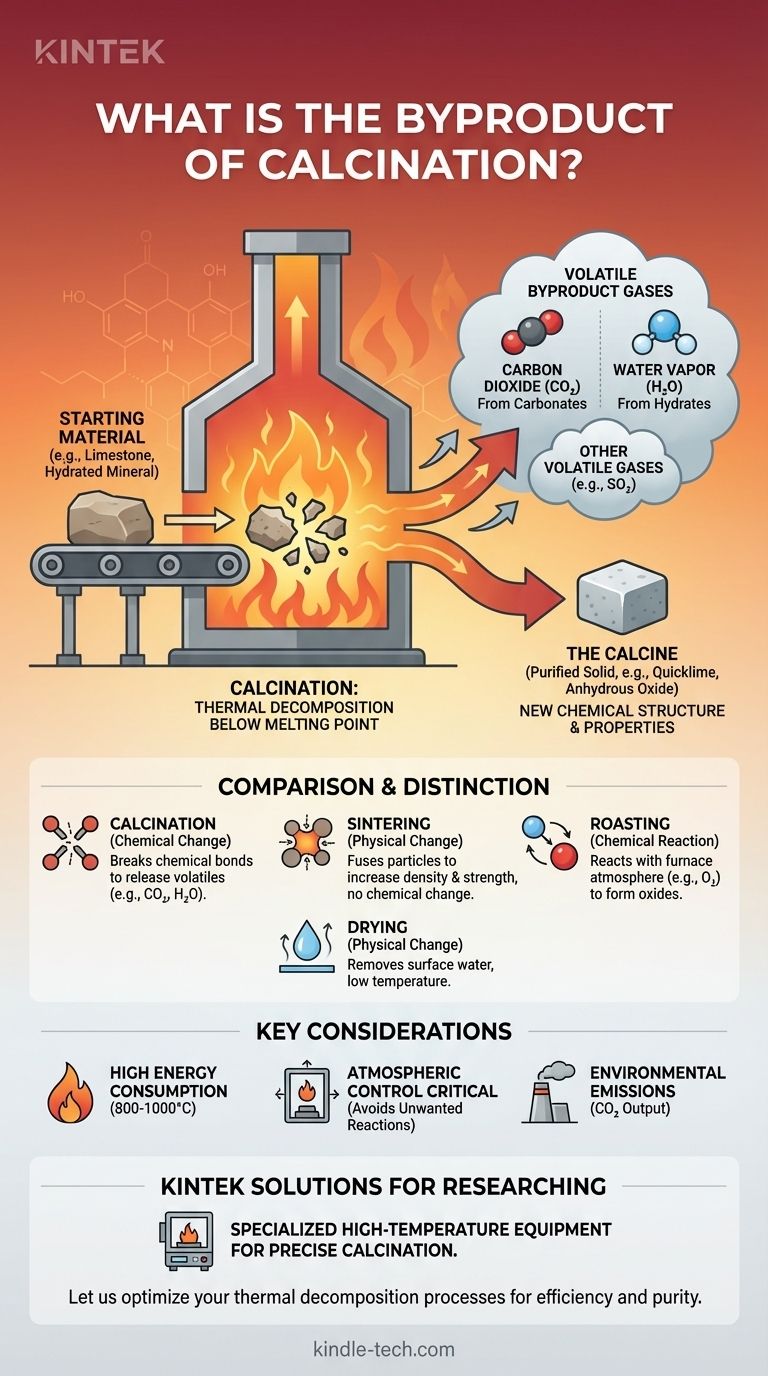
Dans presque tous les cas, le principal sous-produit de la calcination est un gaz. Il s'agit le plus souvent de dioxyde de carbone (CO2) lors du chauffage de carbonates comme le calcaire, ou de vapeur d'eau (H2O) lors du chauffage de minéraux hydratés. Le processus est une forme de décomposition thermique, où une chaleur intense décompose un composé en un solide purifié et en gaz volatils qui sont éliminés.
La calcination est un processus de transformation chimique, pas simplement de purification. Elle utilise une chaleur élevée en dessous du point de fusion pour décomposer un matériau, modifiant fondamentalement sa structure chimique en éliminant les sous-produits volatils comme le dioxyde de carbone ou la vapeur d'eau.

Qu'est-ce que la calcination ? Un regard plus approfondi
La calcination est un processus fondamental en métallurgie et en science des matériaux, particulièrement dans la production de ciment, de chaux et dans le raffinage de certains minerais. Comprendre le mécanisme est essentiel pour comprendre son objectif.
Le principe de base : la décomposition thermique
Au fond, la calcination consiste à rompre des liaisons chimiques par la chaleur. L'énergie appliquée provoque la décomposition du matériau de départ en deux substances nouvelles ou plus.
L'une de ces substances est le produit solide désiré, souvent appelé le « calciné ». Les autres substances sont les sous-produits gazeux qui sont éliminés.
Explication des sous-produits courants
Le sous-produit spécifique dépend entièrement de la composition chimique du matériau chauffé.
- Dioxyde de carbone (CO2) : C'est l'exemple le plus connu. Lorsque le carbonate de calcium (CaCO3, calcaire) est calciné, il se décompose en oxyde de calcium (CaO, chaux vive) et libère du gaz CO2. C'est la réaction centrale dans la fabrication du ciment.
- Vapeur d'eau (H2O) : De nombreux minéraux existent sous forme d'hydrates, ce qui signifie qu'ils contiennent des molécules d'eau piégées dans leur structure cristalline. La calcination de la bauxite (minerai d'aluminium) ou du gypse élimine cette eau chimiquement liée sous forme de vapeur.
- Autres gaz volatils : Dans des applications plus spécifiques, d'autres gaz peuvent être libérés. Par exemple, le chauffage de certains sulfates peut libérer du dioxyde de soufre (SO2), bien que ce processus chevauche souvent une technique connexe appelée grillage.
Le produit désiré : le calciné
Le matériau solide restant après l'élimination des sous-produits volatils est l'objectif principal. Ce calciné résultant possède désormais des propriétés chimiques et physiques différentes.
Par exemple, la chaux vive produite par la calcination du calcaire est très réactive, ce qui est essentiel pour fabriquer du ciment et d'autres produits chimiques industriels.
Comment la calcination diffère des autres traitements thermiques
Le terme « calcination » est souvent confondu avec d'autres processus à haute température. La distinction réside dans l'objectif chimique ou physique sous-jacent.
Calcination par rapport au frittage
La calcination modifie la composition chimique d'un matériau. Elle décompose un composé en un autre en éliminant des composants volatils.
Le frittage, comme le note correctement la référence, modifie la forme physique d'un matériau. Il utilise la chaleur pour fusionner de petites particules ensemble en une seule pièce solide sans les faire fondre, augmentant ainsi sa résistance et sa densité. La composition chimique reste inchangée.
Calcination par rapport au grillage
C'est un point de confusion très courant. La calcination est généralement effectuée dans une atmosphère contrôlée ou inerte pour provoquer la décomposition.
Le grillage, en revanche, est un processus qui implique une réaction chimique avec l'atmosphère du four, spécifiquement avec l'oxygène. C'est une forme d'oxydation, souvent utilisée pour convertir les minerais de sulfure métallique en oxydes métalliques.
Calcination par rapport au séchage
Le séchage est un processus à basse température qui élimine l'eau physiquement absorbée de la surface d'une substance.
La calcination est un processus à haute température qui élimine l'eau chimiquement liée ou d'autres composés volatils de la structure cristalline du matériau, nécessitant beaucoup plus d'énergie pour rompre ces liaisons chimiques.
Comprendre les pièges et le contexte
Bien que puissante, la calcination est un processus industriel avec des considérations opérationnelles importantes qui doivent être gérées.
Consommation d'énergie élevée
Atteindre et maintenir les températures élevées requises pour rompre les liaisons chimiques (souvent 800-1000°C ou plus) fait de la calcination un processus extrêmement gourmand en énergie et coûteux.
Le contrôle de l'atmosphère est crucial
La composition du gaz à l'intérieur du four est essentielle. Des réactions indésirables, telles que l'oxydation due à un excès d'air, peuvent se produire si l'atmosphère n'est pas soigneusement contrôlée, entraînant un produit final impur.
Émissions environnementales
Les sous-produits gazeux sont une production principale. La calcination du calcaire pour la production de ciment est l'une des plus grandes sources industrielles d'émissions mondiales de CO2, un facteur critique dans la gestion et la réglementation environnementales.
Faire le bon choix pour votre objectif
Comprendre la calcination permet de reconnaître son rôle spécifique dans la création des matériaux qui façonnent notre monde.
- Si votre objectif principal est de produire du ciment ou de la chaux : La calcination est le processus central utilisé pour décomposer le calcaire (CaCO3) en chaux vive réactive (CaO) en éliminant le CO2.
- Si votre objectif principal est de préparer un catalyseur ou un adsorbant : La calcination est utilisée pour éliminer l'eau et les précurseurs volatils, créant un matériau pur à haute surface spécifique prêt à l'emploi.
- Si votre objectif principal est de renforcer une pièce en céramique ou en poudre métallique : Vous pensez au frittage, qui compacte les particules pour augmenter la densité, et non à la calcination qui modifie leur chimie.
En fin de compte, la calcination est un outil fondamental pour modifier chimiquement un matériau solide en utilisant la chaleur pour libérer ses composants volatils.
Tableau récapitulatif :
| Matériau de calcination | Gaz sous-produit courant | Produit solide principal |
|---|---|---|
| Calcaire (CaCO₃) | Dioxyde de carbone (CO₂) | Chaux vive (CaO) |
| Minéraux hydratés (ex. : Bauxite, Gypse) | Vapeur d'eau (H₂O) | Oxyde anhydre |
| Certains sulfates | Dioxyde de soufre (SO₂) | Oxyde métallique |
Besoin d'un traitement thermique précis pour vos matériaux ?
La calcination est une étape critique dans la production de tout, du ciment aux catalyseurs. KINTEK est spécialisée dans les équipements de laboratoire à haute température, y compris les fours idéaux pour les processus de calcination contrôlée. Nos solutions vous aident à obtenir les transformations chimiques exactes dont vous avez besoin, en mettant l'accent sur l'efficacité et la pureté.
Que vous développiez de nouveaux matériaux, raffiniez des minerais ou prépariez des catalyseurs, l'expertise de KINTEK en matière d'équipement de laboratoire peut soutenir votre R&D et votre contrôle qualité. Laissez-nous vous aider à optimiser vos processus de décomposition thermique.
Contactez KINTEK dès aujourd'hui pour discuter de vos besoins spécifiques en matière de calcination et découvrir l'équipement adapté à votre laboratoire.
Guide Visuel
Produits associés
- Fourneuse de pyrolyse de four rotatif électrique Machine calcineuse Petit four rotatif Four rotatif
- Four rotatif continu scellé sous vide Four rotatif
- Petite usine de pyrolyse continue à four rotatif électrique pour le chauffage
- Four rotatif électrique pour pyrolyse de biomasse
- Four de régénération électrique pour charbon actif à four rotatif
Les gens demandent aussi
- Quelle est la différence entre la calcination et la torréfaction ? Un guide sur le traitement à haute température
- Quels sont les types de réacteurs de pyrolyse utilisés dans l'industrie ? Choisissez la bonne technologie pour votre produit
- Quelles sont les zones d'un four rotatif dans la production de ciment ? Maîtrisez le processus de base pour un clinker de haute qualité
- Quel est le principe du four rotatif ? Maîtriser le traitement thermique continu
- Quelle biomasse est utilisée en pyrolyse ? Sélectionner la matière première optimale pour vos objectifs



















