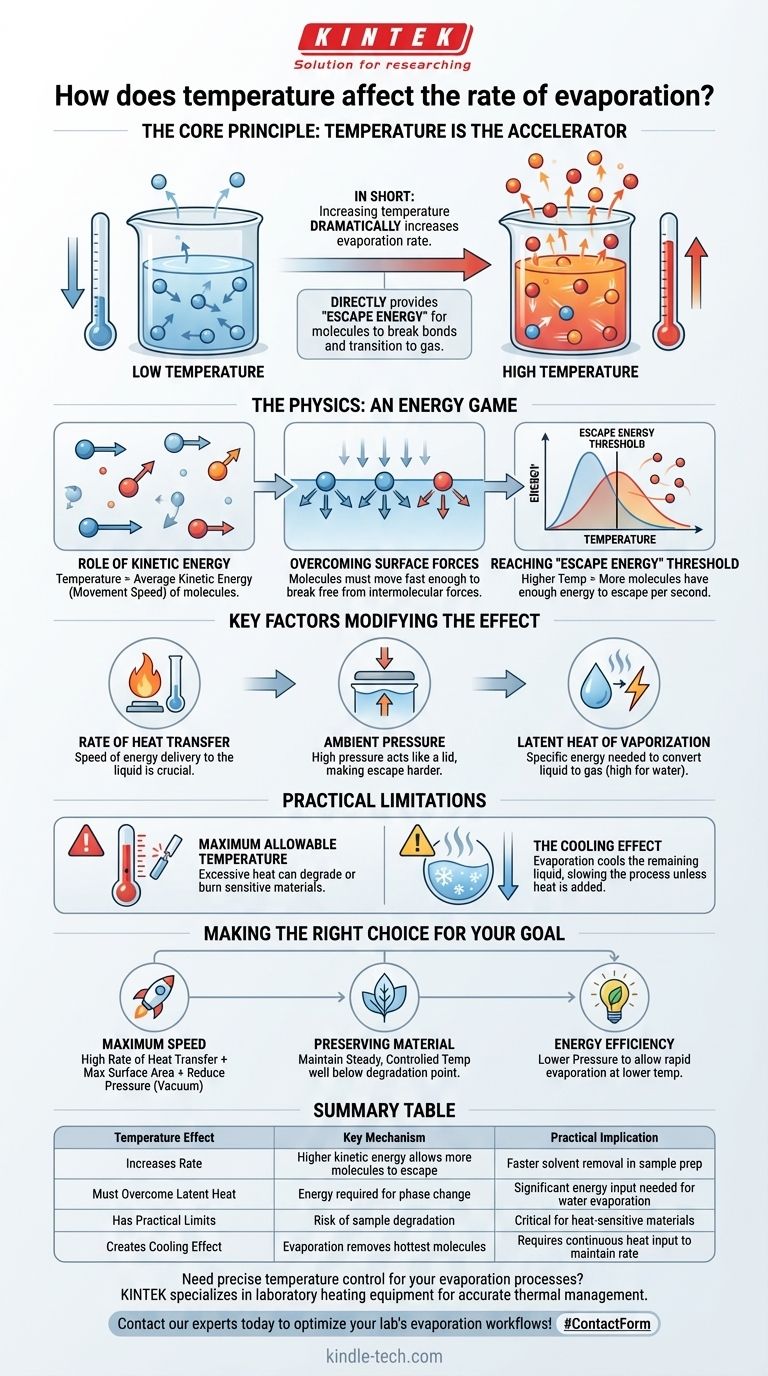
En bref, l'augmentation de la température d'un liquide augmente considérablement son taux d'évaporation. Cela se produit parce que la chaleur est une forme d'énergie. Lorsque vous ajoutez de la chaleur à un liquide, vous augmentez l'énergie cinétique de ses molécules, ce qui les fait bouger plus vite et leur permet de s'échapper plus facilement de la surface du liquide vers l'air sous forme de gaz.
Le principe fondamental est le suivant : la température est l'accélérateur de l'évaporation. Elle fournit directement « l'énergie d'évasion » dont les molécules individuelles ont besoin pour rompre leurs liaisons avec le liquide et passer à l'état gazeux.

La physique de l'évaporation : un jeu d'énergie
L'évaporation n'est pas seulement une question d'ébullition ; c'est un processus continu qui se produit à la surface d'un liquide. Le rôle de la température est mieux compris en examinant ce qui se passe au niveau moléculaire.
Le rôle de l'énergie cinétique
La température est fondamentalement une mesure de l'énergie cinétique moyenne — ou vitesse de mouvement — des molécules d'une substance. Dans un verre d'eau, certaines molécules se déplacent lentement, d'autres à une vitesse moyenne, et certaines se déplacent très rapidement.
Surmonter les forces de surface
Les molécules d'un liquide sont maintenues ensemble par des forces intermoléculaires. Pour qu'une molécule à la surface s'évapore, elle doit se déplacer suffisamment vite pour se libérer de ces forces d'attraction qui la tirent vers l'intérieur du liquide.
Atteindre le seuil d'« énergie d'évasion »
L'augmentation de la température augmente l'énergie cinétique moyenne de toutes les molécules. Cela signifie qu'un pourcentage beaucoup plus important de molécules possède désormais suffisamment d'énergie individuelle pour vaincre les forces de surface et s'échapper. Plus la température est élevée, plus le nombre de molécules franchissant ce seuil d'« énergie d'évasion » par seconde est grand, ce qui entraîne un taux d'évaporation plus rapide.
Facteurs clés qui modifient l'effet de la température
Bien que la température soit le moteur principal, son efficacité est influencée par plusieurs autres facteurs critiques. Une compréhension véritable du système nécessite d'examiner au-delà de la seule température.
Taux de transfert de chaleur
La vitesse à laquelle vous pouvez fournir de l'énergie thermique au liquide est cruciale. Un grand volume d'eau chauffé par une petite flamme ne s'évaporera pas rapidement, car la chaleur n'est pas transférée efficacement à toutes les molécules.
Pression ambiante
L'évaporation se produit lorsque les molécules s'échappent dans l'air environnant. Si la pression de l'air au-dessus du liquide est élevée, elle agit comme un couvercle, rendant physiquement plus difficile pour les molécules de quitter la surface. C'est pourquoi l'eau bout à une température plus basse en haute altitude où la pression est plus faible.
Chaleur latente de vaporisation
C'est la quantité spécifique d'énergie requise pour convertir un kilogramme de liquide en gaz à une température constante. L'eau a une chaleur latente très élevée, ce qui signifie qu'il faut une quantité importante d'énergie pour la faire s'évaporer, d'où l'efficacité de la transpiration comme mécanisme de refroidissement.
Comprendre les limites pratiques
Vous ne pouvez pas simplement augmenter la température indéfiniment pour accélérer l'évaporation. Les applications du monde réel ont des contraintes qui doivent être respectées.
Température maximale admissible
De nombreuses substances changent ou se décomposent lorsqu'elles sont chauffées excessivement. Par exemple, lors de l'évaporation de l'eau d'un produit alimentaire, une chaleur excessive peut brûler l'aliment, altérant sa structure chimique et ruinant le produit final. Chaque processus a un plafond de température.
L'effet refroidissant de l'évaporation
Un compromis fascinant et critique est que l'évaporation elle-même est un processus de refroidissement. Les molécules possédant le plus d'énergie sont celles qui s'échappent, laissant derrière elles les molécules de plus basse énergie (plus froides). Cela signifie qu'une évaporation rapide refroidira activement le liquide restant, ce qui, à son tour, ralentira l'évaporation ultérieure, à moins que vous ne fournissiez continuellement plus de chaleur.
Faire le bon choix pour votre objectif
Contrôler l'évaporation consiste à équilibrer ces facteurs pour atteindre un objectif spécifique.
- Si votre objectif principal est la vitesse maximale : Vous devez fournir un taux élevé de transfert de chaleur pour maintenir une température élevée, tout en maximisant la surface et, si possible, en réduisant la pression ambiante (en créant un vide).
- Si votre objectif principal est la préservation d'un matériau sensible : Votre objectif est de maintenir une température stable et contrôlée bien en dessous du point de dégradation du matériau, acceptant un taux d'évaporation potentiellement plus lent pour un résultat de meilleure qualité.
- Si votre objectif principal est l'efficacité énergétique : La stratégie la plus efficace est souvent de réduire la pression. Cela permet une évaporation rapide à une température beaucoup plus basse, réduisant considérablement l'énergie nécessaire au processus.
En fin de compte, maîtriser l'évaporation revient à gérer précisément l'énergie du système pour obtenir le résultat souhaité.
Tableau récapitulatif :
| Effet de la température | Mécanisme clé | Implication pratique |
|---|---|---|
| Augmente le taux | Une énergie cinétique plus élevée permet à plus de molécules de s'échapper | Élimination plus rapide du solvant lors de la préparation des échantillons |
| Doit vaincre la chaleur latente | Énergie requise pour le changement de phase | Apport énergétique important nécessaire pour l'évaporation de l'eau |
| A des limites pratiques | Risque de dégradation de l'échantillon à haute température | Crucial pour les matériaux sensibles à la chaleur |
| Crée un effet de refroidissement | L'évaporation élimine les molécules les plus chaudes | Nécessite un apport de chaleur continu pour maintenir le taux |
Besoin d'un contrôle précis de la température pour vos processus d'évaporation ? KINTEK est spécialisée dans les équipements de chauffage de laboratoire, y compris les systèmes d'évaporation, les plaques chauffantes et les étuves conçus pour une gestion thermique précise. Nos solutions vous aident à obtenir des taux d'évaporation plus rapides tout en protégeant les échantillons sensibles. Contactez nos experts dès aujourd'hui pour discuter de la manière dont nous pouvons optimiser les flux de travail d'évaporation de votre laboratoire !
Guide Visuel
Produits associés
- Bain-marie thermoplongeur chauffant à température constante pour bain de réaction
- Creuset en nitrure de bore conducteur pour revêtement par évaporation par faisceau d'électrons Creuset BN
- Creuset et bateau d'évaporation en cuivre sans oxygène pour revêtement par évaporation par faisceau d'électrons
- Creuset de faisceau d'électrons Creuset de faisceau d'électrons pour évaporation
- Bateau d'évaporation spécial en molybdène, tungstène et tantale
Les gens demandent aussi
- Qu'est-ce que la méthode d'évaporation thermique en couches minces ? Un guide pour une PVD simple et rentable
- Le dépôt est-il identique à l'évaporation ? Démêler la hiérarchie de la technologie des films minces
- Qu'est-ce que la méthode de dépôt thermique ? Un guide sur la technologie de revêtement en couches minces
- Quels sont les avantages du dépôt par évaporation ?Obtenir une qualité de film mince supérieure
- Quels sont les avantages du dépôt par faisceau d'électrons ? Obtenir des films minces de haute pureté et à point de fusion élevé
- Qu'est-ce que la vaporisation du zinc ? Un défi critique en matière de sécurité et de qualité en soudage
- Quelle est la différence entre l'évaporation thermique et l'évaporation par faisceau d'électrons ? Choisissez la bonne méthode PVD pour votre laboratoire
- Qu'est-ce que le dépôt de couches minces sous vide ? La clé de l'ingénierie de surface avancée



















