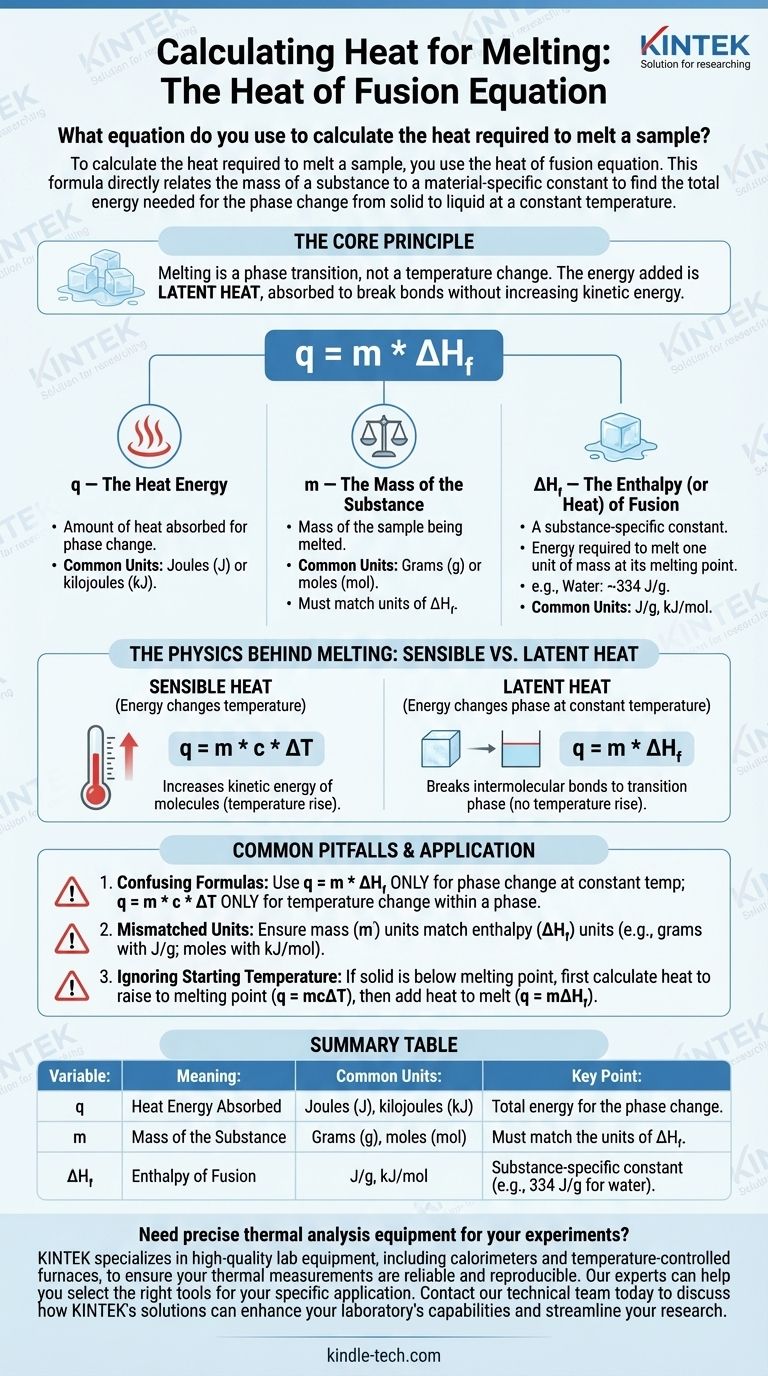
Pour calculer la chaleur nécessaire pour faire fondre un échantillon, vous utilisez l'équation de la chaleur de fusion. Cette formule relie directement la masse d'une substance à une constante spécifique au matériau pour trouver l'énergie totale nécessaire au changement de phase de l'état solide à l'état liquide à une température constante.
Le principe fondamental est que la fusion est une transition de phase, et non un changement de température. L'énergie que vous ajoutez est appelée chaleur latente, qui est absorbée pour rompre les liaisons de la structure solide sans augmenter l'énergie cinétique des molécules.

Déconstruction de l'équation de la chaleur de fusion
La formule pour calculer la chaleur absorbée pendant la fusion est :
q = m * ΔH_f
Chaque variable de cette équation représente un élément essentiel du processus physique. Les comprendre individuellement est la clé pour appliquer correctement la formule.
q — L'énergie thermique
q représente la quantité de chaleur absorbée par la substance pour subir le changement de phase. Cette valeur est généralement exprimée en Joules (J) ou en kilojoules (kJ), bien que des contextes plus anciens puissent utiliser des calories (cal).
m — La masse de la substance
m est la masse de l'échantillon que vous faites fondre. Il est crucial que les unités de masse, généralement les grammes (g) ou les moles (mol), correspondent aux unités utilisées dans la constante de chaleur de fusion pour cette substance.
ΔH_f — L'enthalpie (ou chaleur) de fusion
ΔH_f est la variable la plus importante. C'est l'enthalpie de fusion, souvent appelée chaleur latente de fusion.
C'est une constante physique unique à chaque substance. Elle définit la quantité d'énergie requise pour faire fondre une unité de masse (par exemple, 1 gramme ou 1 mole) de cette substance à son point de fusion.
Par exemple, la chaleur de fusion de l'eau est d'environ 334 Joules par gramme (J/g). Cela signifie que vous devez ajouter 334 Joules d'énergie pour faire fondre 1 gramme de glace à 0°C en 1 gramme d'eau liquide à 0°C.
La physique derrière la fusion : Chaleur sensible vs. chaleur latente
Un point de confusion courant est de savoir pourquoi la température n'augmente pas pendant la fusion. Ceci est expliqué par la différence entre deux types d'énergie thermique.
Chaleur sensible
La chaleur sensible est l'énergie qui modifie la température d'une substance. Lorsque vous ajoutez de la chaleur sensible, vous augmentez l'énergie cinétique des molécules, les faisant se déplacer plus rapidement, ce que nous mesurons comme une augmentation de température. La formule pour cela est q = m * c * ΔT.
Chaleur latente
La chaleur latente est l'énergie absorbée ou libérée lors d'un changement de phase à température constante. Pendant la fusion, l'énergie entrante est entièrement utilisée pour rompre les liaisons intermoléculaires maintenant le réseau cristallin du solide, le faisant passer à l'état liquide.
Parce que l'énergie est "cachée" dans le changement de phase plutôt que de provoquer une augmentation de température, elle est appelée latente.
Pièges courants à éviter
Appliquer un concept ou une formule erronée est une source fréquente d'erreurs dans les calculs thermodynamiques. Soyez conscient de ces erreurs courantes.
Confondre la chaleur de fusion avec la chaleur spécifique
L'erreur la plus courante est d'utiliser la mauvaise formule.
- Utilisez
q = m * ΔH_f(Chaleur de fusion) UNIQUEMENT pour un changement de phase à température constante (par exemple, faire fondre de la glace à 0°C). - Utilisez
q = m * c * ΔT(Chaleur spécifique) UNIQUEMENT pour modifier la température d'une substance au sein d'une seule phase (par exemple, chauffer de la glace solide de -10°C à 0°C).
Unités incompatibles
Vérifiez toujours vos unités. Si votre masse (m) est en grammes, votre chaleur de fusion (ΔH_f) doit être en Joules par gramme (J/g). Si ΔH_f est donné en kilojoules par mole (kJ/mol), vous devez d'abord convertir la masse de votre échantillon en moles.
Ignorer la température de départ
L'équation de la chaleur de fusion ne s'applique que si la substance est déjà à son point de fusion. Si vous avez un solide en dessous de son point de fusion, vous devez effectuer un calcul en deux étapes :
- Calculez la chaleur nécessaire pour élever le solide à son point de fusion (
q = mcΔT). - Calculez la chaleur nécessaire pour faire fondre le solide à son point de fusion (
q = mΔH_f). - Additionnez les résultats pour obtenir la chaleur totale requise.
Application de la formule correcte pour votre calcul
Pour vous assurer de résoudre correctement votre problème, identifiez le processus exact que vous devez calculer.
- Si votre objectif principal est de faire fondre une substance déjà à son point de fusion : Vous n'avez besoin que de l'équation de la chaleur de fusion :
q = m * ΔH_f. - Si votre objectif principal est de chauffer une substance sans changer sa phase : Vous n'avez besoin que de l'équation de la capacité thermique spécifique :
q = m * c * ΔT. - Si votre objectif principal est de chauffer un solide puis de le faire fondre complètement : Vous devez calculer la chaleur pour les deux étapes séparément et les additionner :
q_total = (m * c * ΔT)_chauffage + (m * ΔH_f)_fusion.
Comprendre le processus physique que vous modélisez est la clé pour choisir la bonne équation.
Tableau récapitulatif :
| Variable | Signification | Unités courantes | Point clé |
|---|---|---|---|
| q | Énergie thermique absorbée | Joules (J), kilojoules (kJ) | Énergie totale pour le changement de phase |
| m | Masse de la substance | Grammes (g), moles (mol) | Doit correspondre aux unités de ΔH_f |
| ΔH_f | Enthalpie de fusion | J/g, kJ/mol | Constante spécifique à la substance (par exemple, 334 J/g pour l'eau) |
Besoin d'équipement d'analyse thermique précis pour vos expériences ?
Le calcul précis des besoins en chaleur est fondamental en science des matériaux, en chimie et en pharmacie. KINTEK est spécialisé dans les équipements de laboratoire de haute qualité, y compris les calorimètres et les fours à température contrôlée, pour garantir que vos mesures thermiques sont fiables et reproductibles.
Nos experts peuvent vous aider à sélectionner les bons outils pour votre application spécifique, que vous étudiiez les changements de phase, la synthèse de matériaux ou la cinétique des réactions.
Contactez notre équipe technique dès aujourd'hui pour discuter de la manière dont les solutions de KINTEK peuvent améliorer les capacités de votre laboratoire et rationaliser votre recherche.
Guide Visuel
Produits associés
- Presse hydraulique chauffante avec plaques chauffantes manuelles intégrées pour utilisation en laboratoire
- Machine de presse hydraulique chauffante 24T 30T 60T avec plaques chauffantes pour presse à chaud de laboratoire
- Presse chauffante électrique de laboratoire cylindrique pour applications de laboratoire
- Presse hydraulique chauffante automatique avec plaques chauffantes pour presse à chaud de laboratoire 25T 30T 50T
- Moule de presse infrarouge de laboratoire
Les gens demandent aussi
- Comment fonctionnent les chambres de revêtement ? Réalisez une transformation de surface au niveau atomique avec le PVD
- Pourquoi le graphite peut-il conduire la chaleur ? Déverrouiller ses propriétés thermiques anisotropes
- Quels sont les avantages et les inconvénients de la fabrication métallique ? Libérez une résistance et une flexibilité de conception inégalées
- Comment fonctionne une fournaise à 3 étapes ? Obtenez un confort et une efficacité supérieurs
- Quelles sont les étapes d'un four à arc électrique ? Le cycle complet de coulée à coulée expliqué
- Quelle est la température d'une étuve de laboratoire ? Un guide pour choisir le bon type pour votre application
- Quels sont les facteurs qui affectent l'efficacité du transfert de chaleur ? Optimisez votre système de gestion thermique
- Quels sont les avantages de l'utilisation des pompes à vide à diaphragme sans huile ? Obtenez un vide propre et nécessitant peu d'entretien


























