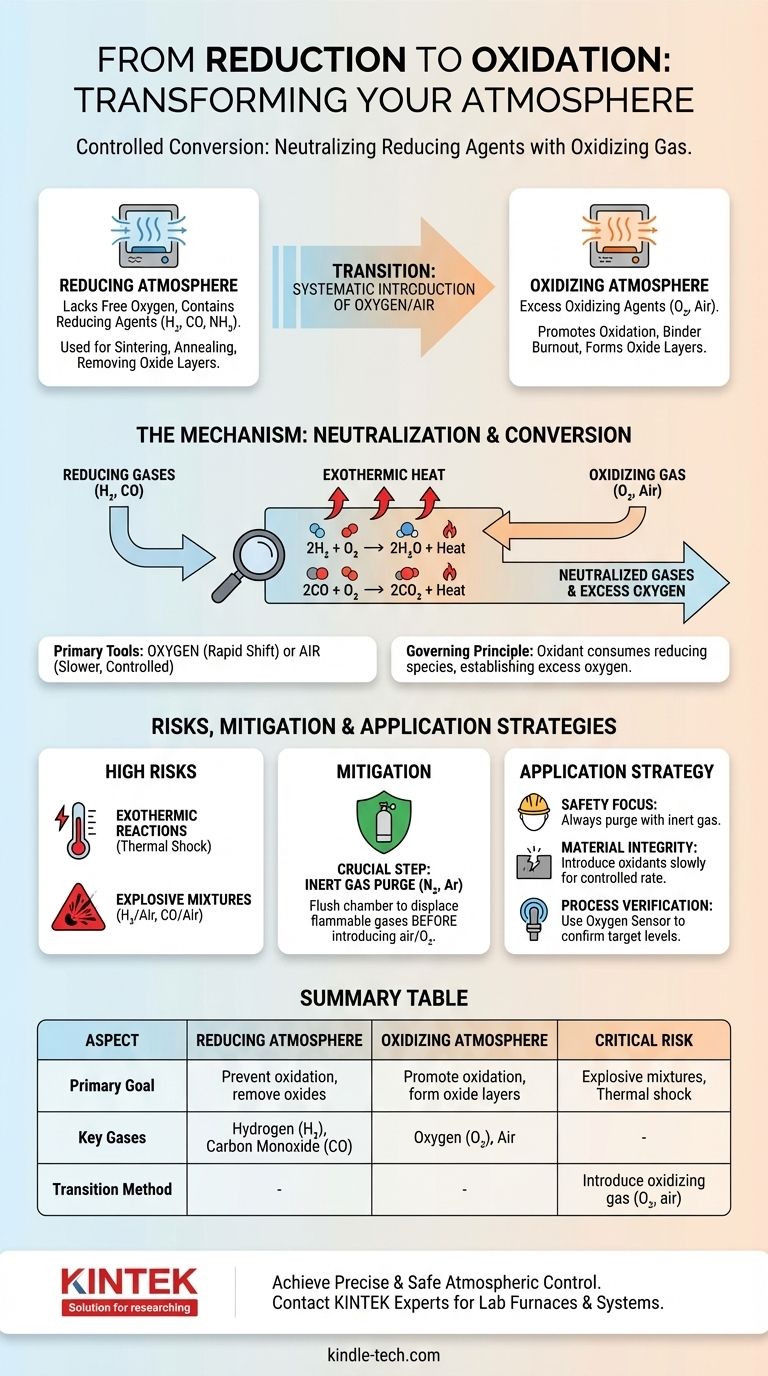
La transformation d'une atmosphère réductrice en une atmosphère oxydante est réalisée en introduisant systématiquement un gaz oxydant, le plus souvent de l'oxygène ou de l'air. Ce processus neutralise les agents réducteurs actifs présents, tels que l'hydrogène ou le monoxyde de carbone, en réagissant avec eux pour former des molécules plus stables comme l'eau et le dioxyde de carbone, modifiant ainsi fondamentalement le potentiel chimique de l'environnement.
Le passage d'une atmosphère réductrice à une atmosphère oxydante est une conversion chimique contrôlée. Il ne s'agit pas seulement de dilution ; il s'agit de fournir délibérément un oxydant pour consommer les espèces réductrices et créer un excès d'oxygène.
Comprendre les concepts fondamentaux : Réducteur contre Oxydant
Qu'est-ce qui définit une atmosphère réductrice ?
Une atmosphère réductrice est un environnement qui manque d'oxygène libre et contient des agents réducteurs actifs. Ces agents, comme l'hydrogène (H₂), le monoxyde de carbone (CO) ou l'ammoniac dissocié (NH₃), donnent facilement des électrons ou arrachent des atomes d'oxygène aux matériaux avec lesquels ils entrent en contact.
De telles atmosphères sont utilisées pour prévenir l'oxydation ou pour éliminer activement les couches d'oxyde des métaux et des céramiques lors de processus à haute température, tels que le frittage ou le recuit.
Qu'est-ce qui définit une atmosphère oxydante ?
Une atmosphère oxydante, en revanche, présente un excès d'agent oxydant, le plus souvent de l'oxygène (O₂). Cet environnement favorise l'oxydation, une réaction où un matériau perd des électrons ou se combine avec de l'oxygène.
L'air, qui contient environ 21 % d'oxygène, est l'atmosphère oxydante la plus courante. Ces environnements sont essentiels pour des processus tels que la combustion du liant dans les céramiques ou la création de couches d'oxyde spécifiques à la surface d'un matériau.
Le mécanisme de transition : De la réduction à l'oxydation
Le principe : Neutralisation par réaction
La transition repose sur un principe simple : un agent oxydant réagira avec et neutralisera un agent réducteur. Pour changer l'atmosphère, vous devez introduire suffisamment d'oxydant pour consommer tous les gaz réducteurs présents, puis établir un excès.
L'oxygène et l'air : Les outils principaux
L'oxygène ou l'air sont les gaz standard utilisés pour cette conversion. Le choix entre les deux dépend de la vitesse de réaction requise et du niveau de contrôle nécessaire.
L'oxygène pur fournit un changement plus puissant et plus rapide, tandis que l'air permet une transition plus lente, plus diluée et souvent plus contrôlable.
Les réactions chimiques gouvernantes
Lorsque l'oxygène est introduit dans une atmosphère réductrice chaude typique, il réagit immédiatement avec les agents réducteurs. Les réactions principales sont très favorables et spontanées aux températures de traitement.
Pour une atmosphère d'hydrogène :
2H₂ (gaz) + O₂ (gaz) → 2H₂O (gaz) + Chaleur
Pour une atmosphère de monoxyde de carbone :
2CO (gaz) + O₂ (gaz) → 2CO₂ (gaz) + Chaleur
L'atmosphère ne devient véritablement oxydante qu'une fois que tout le H₂ ou le CO a été converti en H₂O ou CO₂ et qu'un surplus d'O₂ est établi.
Comprendre les risques et les compromis
Risque élevé de réactions exothermiques
Les réactions qui neutralisent les agents réducteurs sont fortement exothermiques, ce qui signifie qu'elles libèrent une quantité importante de chaleur. Une introduction rapide d'oxygène peut provoquer un pic de température soudain à l'intérieur d'un four, endommageant potentiellement l'équipement ou le produit.
Ce choc thermique peut fissurer des matériaux sensibles comme les céramiques ou provoquer des transformations de phase indésirables dans les métaux.
Potentiel de mélanges explosifs
Le risque le plus critique est la création d'une atmosphère explosive. Les mélanges d'hydrogène et d'air (entre 4 % et 75 % de H₂) ou de monoxyde de carbone et d'air (entre 12 % et 75 % de CO) sont explosifs.
Si une source d'inflammation est présente — comme un élément chaud ou une décharge statique — une introduction rapide et incontrôlée d'air ou d'oxygène peut provoquer une violente explosion. Les protocoles de sécurité sont non négociables.
Inertage avec un gaz inerte
Pour atténuer ces risques, une étape intermédiaire cruciale est souvent utilisée : l'inertage avec un gaz inerte. Avant d'introduire de l'air, la chambre du four est purgée avec un gaz comme l'azote (N₂) ou l'argon (Ar).
Cette purge déplace le gaz réducteur inflammable, empêchant la formation d'un mélange explosif lorsque l'oxygène est finalement introduit.
Comment appliquer cela à votre processus
Une transition contrôlée est primordiale pour la sécurité et l'obtention des propriétés matérielles souhaitées. La stratégie correcte dépend entièrement de votre objectif principal.
- Si votre objectif principal est la sécurité : Purgez toujours le gaz réducteur avec un gaz inerte comme l'azote avant d'introduire toute quantité d'air ou d'oxygène.
- Si votre objectif principal est l'intégrité du matériau : Introduisez le gaz oxydant lentement et à un débit contrôlé pour éviter le choc thermique dû à la réaction exothermique.
- Si votre objectif principal est la vérification du processus : Utilisez un capteur d'oxygène ou un analyseur de gaz sur l'échappement du four pour confirmer que tous les agents réducteurs ont été consommés et que vous avez atteint le niveau d'oxygène cible.
Maîtriser cette transition atmosphérique vous donne un contrôle précis sur l'état chimique final et les propriétés physiques de votre matériau.

Tableau récapitulatif :
| Aspect | Atmosphère Réductrice | Atmosphère Oxydante |
|---|---|---|
| Objectif Principal | Prévenir l'oxydation, éliminer les oxydes | Favoriser l'oxydation, former des couches d'oxyde |
| Gaz Clés | Hydrogène (H₂), Monoxyde de Carbone (CO) | Oxygène (O₂), Air |
| Méthode de Transition | Introduction d'un gaz oxydant (O₂, air) pour consommer les agents réducteurs | Atteinte après neutralisation des agents réducteurs |
| Risque Critique | Formation de mélanges explosifs pendant la transition | Choc thermique dû aux réactions exothermiques |
Obtenez un contrôle atmosphérique précis et sûr dans votre laboratoire.
Maîtriser la transition d'une atmosphère réductrice à une atmosphère oxydante est essentiel pour l'intégrité des matériaux et la sécurité de l'opérateur. Que vous frittiez des métaux, recuisiez des céramiques ou développiez de nouveaux matériaux, l'équipement et l'expertise appropriés sont indispensables.
KINTEK est spécialisé dans les fours de laboratoire et les systèmes de contrôle d'atmosphère conçus pour un fonctionnement précis, fiable et sûr. Nos solutions vous aident à :
- Prévenir les mélanges explosifs grâce à des fonctionnalités de sécurité intégrées.
- Contrôler les profils thermiques pour éviter d'endommager vos échantillons.
- Vérifier les résultats des processus avec des équipements de surveillance compatibles.
Laissez KINTEK être votre partenaire pour l'excellence en laboratoire. Contactez nos experts dès aujourd'hui pour discuter de vos besoins spécifiques en matière de four et de contrôle d'atmosphère. Nous fournissons l'équipement et les consommables pour garantir que vos processus soient à la fois réussis et sûrs.
Guide Visuel
Produits associés
- Four à atmosphère contrôlée 1700℃ Four à atmosphère inerte d'azote
- Four à tube de laboratoire à haute température de 1700℃ avec tube en alumine
- Four à atmosphère contrôlée de 1400℃ avec atmosphère d'azote et inerte
- Four à moufle haute température pour déliantage et pré-frittage en laboratoire
- Four de laboratoire tubulaire vertical
Les gens demandent aussi
- Pourquoi l'azote est-il utilisé dans un four ? Un bouclier rentable pour les processus à haute température
- Qu'est-ce qu'une atmosphère inerte ? Un guide pour prévenir l'oxydation et assurer la sécurité
- Quel est l'objectif d'une atmosphère inerte ? Un guide pour protéger vos matériaux et vos processus
- Qu'est-ce qui fournit une atmosphère inerte ? Atteignez la sécurité et la pureté avec l'azote, l'argon ou le CO2
- L'azote peut-il être utilisé pour le brasage ? Conditions clés et applications expliquées



















