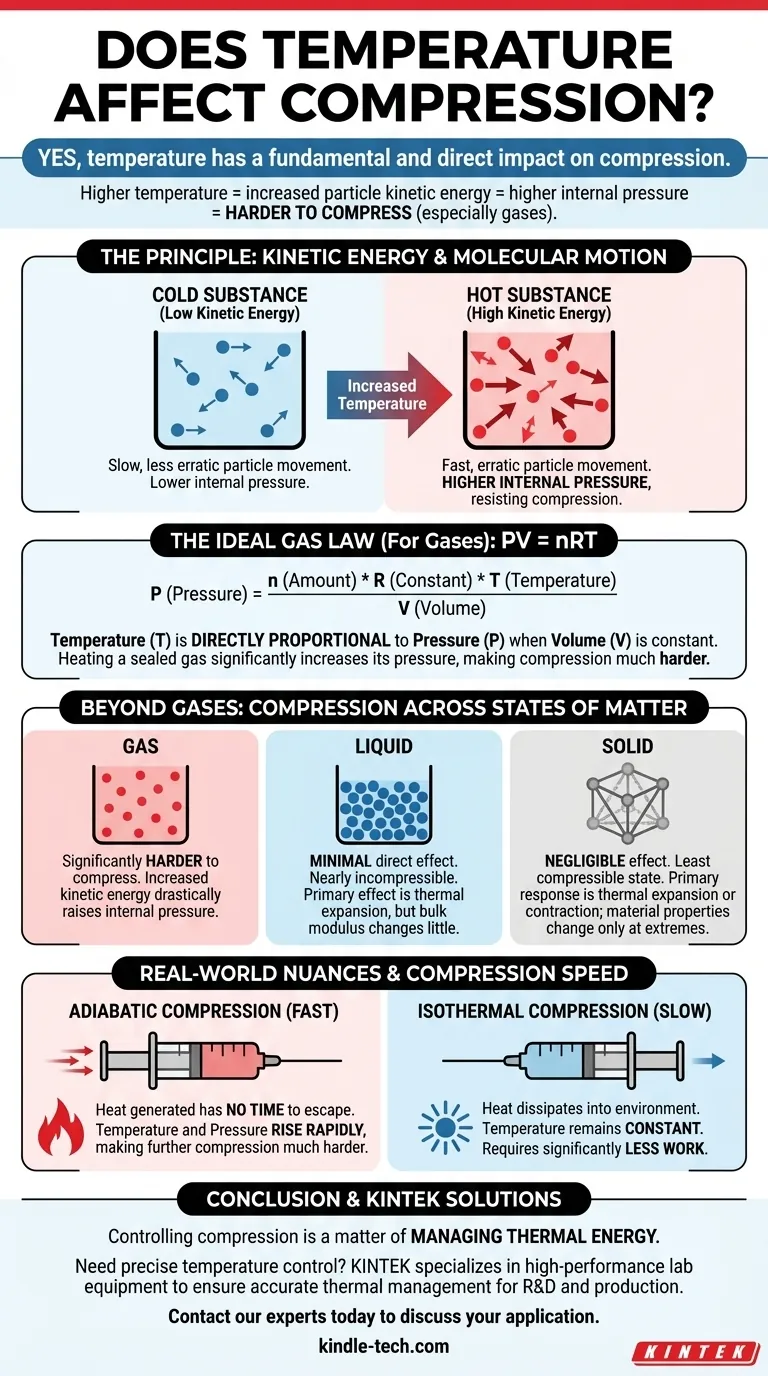
Oui, la température a un impact fondamental et direct sur la compression. Pour les gaz en particulier, lorsque vous augmentez la température d'une substance, ses particules acquièrent de l'énergie cinétique, se déplacent plus rapidement et exercent une pression vers l'extérieur avec une force plus grande. Cette pression interne accrue rend la substance beaucoup plus difficile à comprimer.
Le principe fondamental est une relation directe entre l'énergie et la pression. Une température plus élevée signifie plus d'énergie particulaire, ce qui crée une pression interne plus élevée que vous devez surmonter pour comprimer une substance, en particulier un gaz. Cette relation est une pierre angulaire de la thermodynamique.

Le Principe : Énergie Cinétique et Mouvement Moléculaire
Pour comprendre pourquoi la température affecte la compression, nous devons examiner ce qui se passe au niveau moléculaire.
Ce que Représente la Température
La température n'est pas une propriété abstraite ; c'est une mesure directe de l'énergie cinétique moyenne des atomes ou des molécules au sein d'une substance.
Les particules plus chaudes se déplacent plus vite et de manière plus erratique. Les particules plus froides se déplacent plus lentement.
Comment l'Énergie Cinétique Résiste à la Compression
Lorsque vous comprimez une substance, vous forcez ses particules à se rapprocher. L'énergie cinétique de ces particules crée une pression interne qui s'oppose à cette force externe.
Dans un gaz chaud, les particules en mouvement rapide entrent en collision avec les parois de leur contenant plus fréquemment et avec plus de force. Pour réduire le volume, vous devez appliquer une force externe nettement plus importante pour vaincre cette pression interne puissante.
Quantifier la Relation : La Loi des Gaz Parfaits
Pour les gaz, cette relation est élégamment décrite par un principe fondamental en physique et en chimie.
La Formule : PV = nRT
La loi des gaz parfaits fournit un modèle mathématique pour le comportement de la plupart des gaz dans des conditions courantes. La formule est PV = nRT, où :
- P est la pression
- V est le volume
- n est la quantité de gaz
- R est la constante des gaz parfaits
- T est la température
Le Rôle Direct de la Température
Dans cette équation, la température (T) est directement proportionnelle à la pression (P) si le volume est maintenu constant.
Cela signifie que si vous prenez un récipient d'air scellé et que vous le chauffez, la pression à l'intérieur augmentera. Cette pression accrue est la résistance même que vous ressentez lorsque vous essayez de comprimer un gaz chaud.
Une Analogie Simple : Une Pompe à Vélo
Lorsque vous utilisez une pompe à main pour gonfler un pneu, vous comprimez rapidement l'air. Vous remarquerez que le corps de la pompe devient chaud.
Ce n'est pas seulement dû à la friction. Vous effectuez un travail sur le gaz, ce qui augmente son énergie interne et donc sa température. Cet effet, connu sous le nom de chauffage adiabatique, rend l'air plus difficile à comprimer à mesure que vous pompez plus vite.
Au-delà des Gaz : Liquides et Solides
Bien que l'effet soit plus spectaculaire dans les gaz, la température influence également la compression des liquides et des solides, bien que de différentes manières.
Le Cas des Liquides
Les liquides sont considérés comme quasi incompressibles. Leurs molécules sont déjà en contact étroit, ne laissant que peu d'espace libre.
L'effet principal de la température sur un liquide est la dilatation thermique. Le chauffage d'un liquide provoquera une légère expansion, mais sa résistance à la compression (son module de compressibilité) ne change pas aussi radicalement que pour un gaz.
Le Comportement des Solides
Les solides sont l'état de la matière le moins compressible. Comme les liquides, leur réponse principale au changement de température est la dilatation ou la contraction thermique.
Bien que des températures extrêmes puissent affecter les propriétés matérielles d'un solide, comme la rigidité, l'impact direct sur sa compressibilité est négligeable dans la plupart des scénarios d'ingénierie par rapport à l'effet sur les gaz.
Pièges Courants et Nuances du Monde Réel
La loi des gaz parfaits est un modèle puissant, mais les applications du monde réel présentent des complexités importantes.
Gaz Parfait vs. Gaz Réel
La loi des gaz parfaits suppose que les particules de gaz n'ont pas de volume et n'ont pas d'attractions intermoléculaires. C'est une simplification utile, mais les gaz réels s'écartent de ce modèle à des pressions très élevées ou à des températures très basses.
Compression Adiabatique vs. Isotherme
La vitesse de compression est extrêmement importante.
- Compression Adiabatique (Rapide) : Lorsque vous comprimez un gaz rapidement, la chaleur générée n'a pas le temps de s'échapper. Cette augmentation de température élève la pression interne, rendant la compression ultérieure beaucoup plus difficile.
- Compression Isotherme (Lente) : Si vous comprimez un gaz très lentement, la chaleur peut se dissiper dans l'environnement, maintenant la température constante. Cela nécessite beaucoup moins de travail que la compression adiabatique.
Faire le Bon Choix pour Votre Objectif
Votre approche dépend entièrement de ce que vous essayez d'accomplir.
- Si votre objectif principal est l'ingénierie d'un système pneumatique ou hydraulique : Vous devez gérer activement la chaleur. L'augmentation de température due à la compression rapide (chauffage adiabatique) augmentera considérablement la force requise et peut affecter les joints et la viscosité du fluide.
- Si votre objectif principal est de gérer des conteneurs scellés et pressurisés : Vous devez tenir compte des variations de température ambiante. Un réservoir rempli par une matinée fraîche connaîtra une augmentation de pression significative sous le soleil de l'après-midi, ce qui peut devenir un facteur de sécurité critique.
- Si votre objectif principal est de comprendre la physique fondamentale : Commencez par la loi des gaz parfaits (PV=nRT). C'est le modèle essentiel pour saisir la relation directe et prévisible entre la température, la pression et le volume.
En fin de compte, la température est une forme d'énergie, et contrôler la compression revient à gérer cette énergie.
Tableau Récapitulatif :
| État de la Matière | Effet de l'Augmentation de la Température sur la Compression | Principe Clé |
|---|---|---|
| Gaz | Beaucoup plus difficile à comprimer | Loi des gaz parfaits (PV=nRT) ; l'augmentation de l'énergie cinétique élève la pression interne. |
| Liquide | Effet minimal direct sur la compressibilité (quasi incompressible) | L'effet principal est la dilatation thermique ; le module de compressibilité change peu. |
| Solide | Effet négligeable sur la compressibilité dans la plupart des scénarios | L'effet principal est la dilatation/contraction thermique ; les propriétés du matériau peuvent changer aux extrêmes. |
Besoin d'un contrôle précis de la température pour vos processus de compression ?
Comprendre la thermodynamique de la compression est crucial pour la R&D, le contrôle qualité et l'optimisation des processus. KINTEK est spécialisée dans les équipements de laboratoire haute performance, y compris les étuves, les fours et les systèmes de contrôle de la température, conçus pour vous aider à gérer avec précision l'énergie thermique dans vos expériences et votre production.
Laissez nos experts vous aider à choisir l'équipement adapté pour garantir des résultats fiables et reproductibles. Contactez notre équipe technique dès aujourd'hui pour discuter de vos besoins d'application spécifiques.
Guide Visuel
Produits associés
- Presse isostatique à froid électrique de laboratoire CIP pour pressage isostatique à froid
- Presse Isostatique à Froid Automatique de Laboratoire CIP Presse Isostatique à Froid
- Presse isostatique manuelle à froid CIP pour pastilles
- Presse isostatique à chaud WIP Station de travail 300 MPa pour applications haute pression
- Presse hydraulique manuelle chauffante haute température avec plaques chauffantes pour laboratoire
Les gens demandent aussi
- Pourquoi l'écrouissage est-il préférable au travail à chaud ? Un guide pour choisir le bon processus de formage des métaux
- Quelles sont les applications du pressage isostatique à froid ? Obtenez une densité uniforme pour les pièces complexes
- Quels sont des exemples de pressage isostatique à froid ? Obtenez une densité uniforme dans le compactage de poudre
- Combien coûte une presse isostatique ? Un guide des prix pour le laboratoire par rapport à l'industrie
- Quel est le processus du graphite isostatique ? Un guide pour la création d'un matériau uniforme et haute performance



















