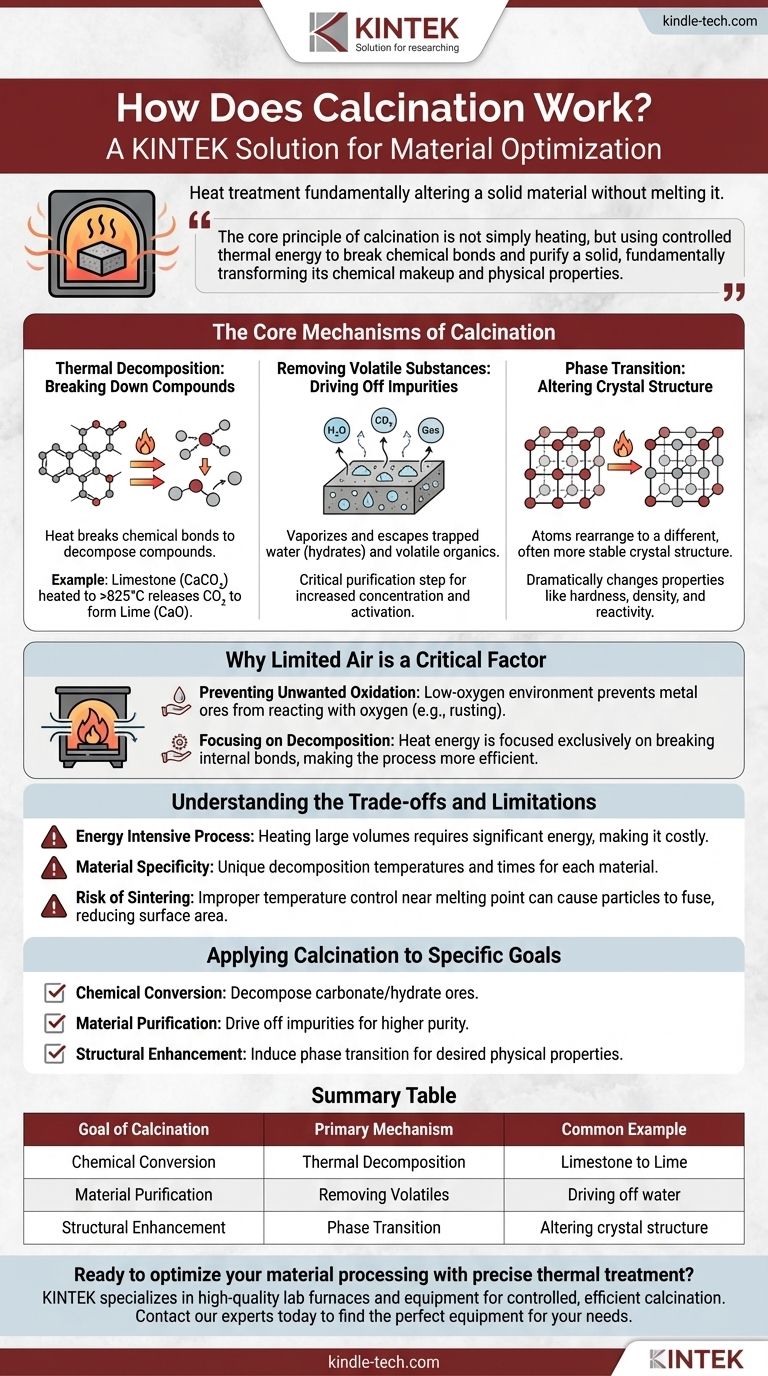
Essentiellement, la calcination est un processus de traitement thermique qui modifie fondamentalement un matériau solide sans le faire fondre. En chauffant une substance à haute température dans un environnement pauvre en oxygène, on force la décomposition thermique, on élimine les impuretés volatiles comme l'eau et le dioxyde de carbone, ou on modifie la structure cristalline interne du matériau.
Le principe fondamental de la calcination n'est pas simplement le chauffage, mais l'utilisation d'une énergie thermique contrôlée pour rompre les liaisons chimiques et purifier un solide, transformant ainsi fondamentalement sa composition chimique et ses propriétés physiques.

Les mécanismes fondamentaux de la calcination
Pour comprendre comment fonctionne la calcination, il faut examiner les trois principaux changements qu'elle peut induire dans un matériau lorsqu'il est soumis à une chaleur intense.
Décomposition thermique : décomposer les composés
C'est l'objectif le plus courant de la calcination. La chaleur fournit l'énergie nécessaire pour rompre les liaisons chimiques au sein d'un composé, provoquant sa décomposition en substances plus simples.
L'exemple classique est la production de chaux (oxyde de calcium) à partir de calcaire (carbonate de calcium). Lorsqu'il est chauffé au-dessus de 825 °C (1517 °F), le calcaire se décompose, libérant du dioxyde de carbone gazeux et laissant derrière lui la chaux purifiée.
Élimination des substances volatiles : éliminer les impuretés
De nombreuses matières premières contiennent de l'eau piégée (hydrates) ou d'autres composés organiques volatils. La calcination chauffe le matériau jusqu'à un point où ces substances se vaporisent et s'échappent.
C'est une étape de purification essentielle, laissant une version plus concentrée ou anhydre (sans eau) du matériau souhaité. Cela augmente la pureté et peut « activer » le matériau pour les processus ultérieurs.
Transition de phase : modifier la structure cristalline
Parfois, l'objectif n'est pas de changer la composition chimique, mais de modifier la forme physique du matériau.
Le chauffage peut amener les atomes d'un solide à se réorganiser en une structure cristalline différente, souvent plus stable ou plus utile. C'est ce qu'on appelle une transition de phase, et cela peut changer radicalement des propriétés telles que la dureté, la densité et la réactivité.
Pourquoi l'air limité est un facteur critique
La condition d'utilisation d'un apport limité d'air (ou d'absence totale d'air) est ce qui distingue la calcination d'autres traitements thermiques comme la torréfaction.
Prévention de l'oxydation indésirable
De nombreux minerais métalliques, lorsqu'ils sont chauffés en présence d'oxygène, réagissent avec celui-ci pour former un oxyde. C'est le même processus de base que la rouille.
En effectuant le chauffage dans un environnement pauvre en oxygène, la calcination empêche spécifiquement ces réactions d'oxydation indésirables de se produire, garantissant que le changement chimique souhaité ait lieu.
Concentration sur la décomposition
L'oxygène étant retiré de l'équation, l'énergie thermique appliquée se concentre exclusivement sur une seule tâche : rompre les liaisons internes du matériau lui-même. Cela rend le processus plus efficace et prévisible pour son objectif visé.
Comprendre les compromis et les limites
Bien que puissante, la calcination est un processus industriel précis avec des considérations importantes.
Processus énergivore
Chauffer de grands volumes de matériaux solides à des centaines, voire des milliers de degrés, nécessite une quantité importante d'énergie. Cela en fait une étape coûteuse et gourmande en ressources dans toute chaîne de production.
Spécificité du matériau
Il n'existe pas de température universelle pour la calcination. Chaque matériau a une température de décomposition et un temps de chauffage requis uniques. Ce qui fonctionne parfaitement pour le calcaire peut être totalement inefficace, voire destructeur, pour un autre type de minerai.
Risque de frittage
Si la température est mal contrôlée et se rapproche trop du point de fusion du matériau, les particules peuvent commencer à fusionner. Ce processus, appelé frittage, peut réduire la surface et la réactivité du produit final, ce qui est souvent indésirable.
Application de la calcination à des objectifs spécifiques
La décision d'utiliser la calcination dépend entièrement du résultat souhaité.
- Si votre objectif principal est la conversion chimique : La calcination est la méthode idéale pour décomposer un minerai de carbonate ou d'hydrate en une forme d'oxyde plus utile.
- Si votre objectif principal est la purification du matériau : Utilisez la calcination pour éliminer les impuretés volatiles comme l'eau ou les solvants résiduels, créant un produit final plus concentré et pur.
- Si votre objectif principal est l'amélioration structurelle : Appliquez la calcination pour induire une transition de phase, modifiant la structure cristalline du matériau pour obtenir les propriétés physiques souhaitées.
En fin de compte, la calcination est un outil fondamental pour concevoir avec précision la composition chimique et les propriétés physiques des matériaux solides.
Tableau récapitulatif :
| Objectif de la calcination | Mécanisme principal | Exemple courant |
|---|---|---|
| Conversion chimique | Décomposition thermique | Calcaire (CaCO₃) en chaux (CaO) |
| Purification du matériau | Élimination des volatils | Élimination de l'eau d'un hydrate |
| Amélioration structurelle | Transition de phase | Modification de la structure cristalline d'un matériau |
Prêt à optimiser votre traitement de matériaux grâce à un traitement thermique précis ? Le processus de calcination est essentiel pour obtenir les bonnes propriétés chimiques et physiques de vos matériaux. KINTEK est spécialisée dans les fours de laboratoire et les équipements de haute qualité conçus pour une calcination contrôlée et efficace. Que vous soyez en recherche, en développement ou en production, nos solutions vous aident à éliminer les impuretés, à induire des transitions de phase et à obtenir des résultats supérieurs. Contactez nos experts dès aujourd'hui pour trouver l'équipement de calcination parfait pour les besoins spécifiques de votre laboratoire.
Guide Visuel
Produits associés
- Four à moufle de 1800℃ pour laboratoire
- Four à moufle de 1700℃ pour laboratoire
- Four à moufle de laboratoire à moufle à levage par le bas
- Four à moufle de four à étuve de 1400℃ pour laboratoire
- Four à moufle haute température pour déliantage et pré-frittage en laboratoire
Les gens demandent aussi
- Comment un four à moufle est-il utilisé pour la digestion d'échantillons ? Un guide sur la calcination à sec pour une analyse précise
- Quels sont les critères d'acceptation pour un four à moufle ? Assurez sécurité, performance et succès
- Quelle est la structure corporelle d'un four ? Dévoiler la conception à double couche pour un contrôle thermique supérieur
- Comment conserver un échantillon dans un four à moufle ? Un guide pour un placement sûr et précis
- Quelles sont les utilisations du four à moufle dans l'industrie pharmaceutique ? Essentiel pour la pureté et la sécurité des médicaments



















