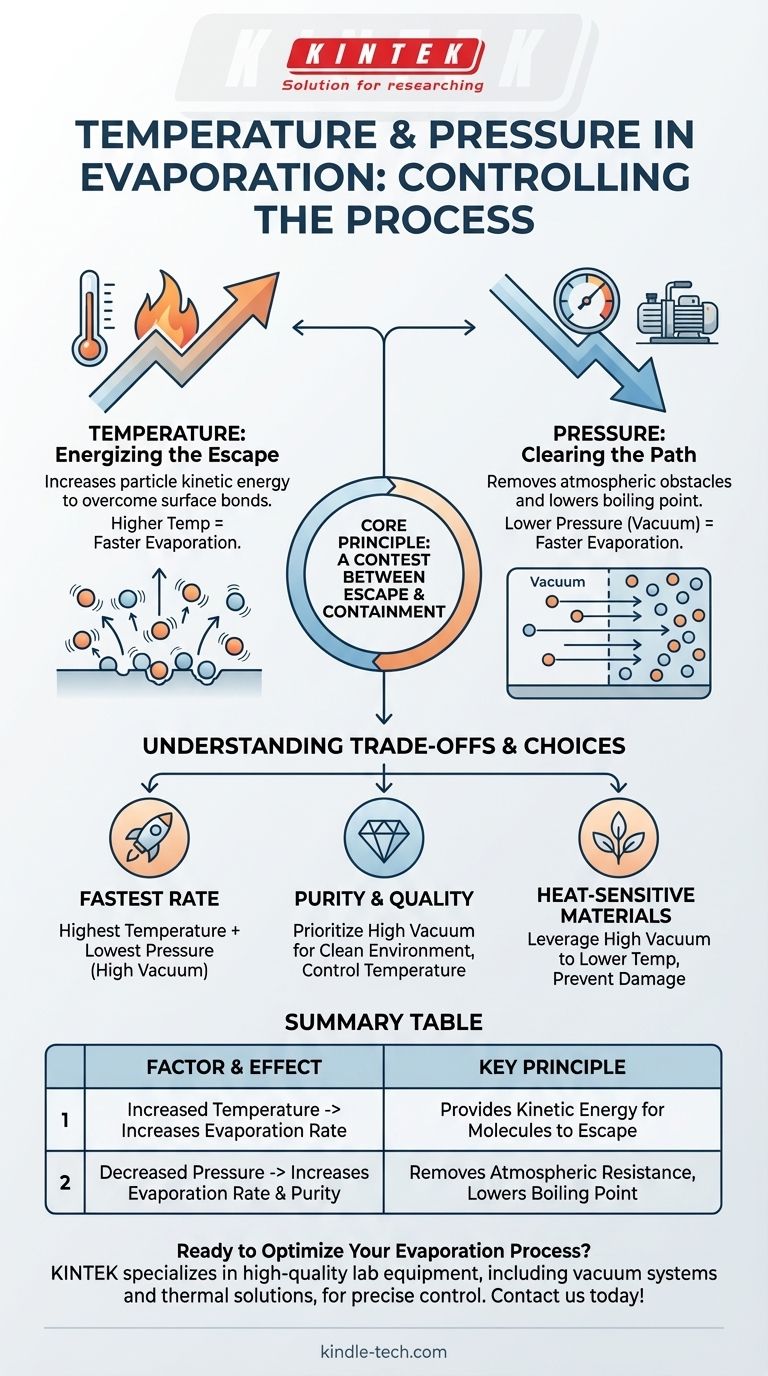
Dans tout processus d'évaporation, la température et la pression sont les deux leviers de contrôle principaux. L'augmentation de la température fournit aux molécules l'énergie nécessaire pour s'échapper d'une surface, augmentant ainsi le taux d'évaporation. Inversement, la diminution de la pression ambiante élimine les obstacles atmosphériques, ce qui augmente également considérablement le taux d'évaporation.
Le principe fondamental est une lutte entre l'évasion et le confinement. La température donne aux molécules l'énergie pour s'échapper, tandis qu'une pression plus faible élimine les forces externes qui les retiennent, rendant l'ensemble du processus plus rapide et plus efficace.

Le rôle de la température : Énergiser l'évasion
La température est le moyen le plus direct d'influencer la rapidité avec laquelle un matériau s'évapore. La relation est basée sur l'énergie des atomes ou des molécules individuelles.
L'énergie cinétique est essentielle
La température est fondamentalement une mesure de l'énergie cinétique moyenne (l'énergie du mouvement) des particules dans une substance.
Lorsque vous chauffez un matériau, vous augmentez la vitesse et la vibration de ses particules constitutives.
Surmonter les liaisons de surface
Pour qu'une particule s'évapore, elle doit avoir suffisamment d'énergie pour rompre les liaisons qui la retiennent à la surface du matériau.
Des températures plus élevées signifient qu'un plus grand pourcentage de particules possède cette « vitesse d'évasion » nécessaire, ce qui entraîne un taux d'évaporation global plus élevé.
Application dans le dépôt de matériaux
Dans les processus tels que le dépôt de couches minces, le chauffage du substrat cible est essentiel. Comme mentionné, le chauffage au-dessus de 150 °C assure une bonne adhérence.
Ceci est dû au fait que les atomes déposés arrivent avec suffisamment d'énergie thermique pour se déplacer légèrement à la surface, s'installant dans une structure cristalline stable, uniforme et bien liée.
Le rôle de la pression : Libérer le chemin
Alors que la température fournit la « poussée » pour l'évaporation, la pression ambiante fournit la « contre-poussée ». La gestion de cette pression externe est souvent tout aussi importante.
Résistance atmosphérique
L'air ou le gaz au-dessus d'une surface exerce une pression, créant une couverture de particules que doit traverser un atome en évaporation.
À pression atmosphérique standard, une particule en évaporation entrera en collision avec des milliards de molécules d'air, ralentissant sa progression et la renvoyant même à la surface.
Le pouvoir du vide
Diminuer la pression, ou créer un vide, élimine ces particules atmosphériques. Cela dégage le chemin pour les atomes en évaporation.
Dans un vide poussé, un atome peut voyager en ligne droite de sa source à sa destination (comme un substrat) avec une probabilité de collision beaucoup plus faible, augmentant considérablement le taux d'évaporation net.
Abaissement du point d'ébullition
Un effet critique de la réduction de la pression est qu'elle diminue le point d'ébullition du matériau. L'ébullition est simplement une évaporation rapide qui se produit lorsque la pression de vapeur interne d'un matériau égale la pression ambiante externe.
En créant un vide, vous pouvez faire évaporer ou bouillir des matériaux à des températures beaucoup plus basses que ce qui serait possible à l'air libre. Ceci est essentiel pour le traitement de matériaux sensibles à la chaleur.
Comprendre les compromis
Le contrôle de la température et de la pression permet d'obtenir des résultats précis, mais cela nécessite d'équilibrer des facteurs concurrents.
Pureté contre Taux
Dans une chambre à vide, l'objectif n'est souvent pas seulement un taux élevé, mais une pureté élevée. Une pression plus faible garantit que moins de molécules de gaz contaminants (comme l'oxygène ou l'azote) sont présentes pour interférer ou être incorporées dans le film déposé final.
Coûts énergétiques contre Coûts d'équipement
Atteindre des températures élevées nécessite un apport énergétique important. Atteindre un vide poussé nécessite des systèmes de pompage coûteux et complexes.
Le choix dépend souvent des propriétés du matériau. Il peut être plus efficace d'utiliser un vide modéré et une température plus élevée pour un matériau robuste, ou un vide poussé et une température plus basse pour un matériau délicat.
Faire le bon choix pour votre objectif
Les réglages optimaux de température et de pression dépendent entièrement de ce que vous essayez d'atteindre avec le processus d'évaporation.
- Si votre objectif principal est le taux d'évaporation le plus rapide possible : Utilisez la température la plus élevée que le matériau peut tolérer, combinée à la pression la plus basse possible (vide le plus élevé).
- Si votre objectif principal est la pureté du matériau et la qualité du film : Privilégiez l'obtention d'un vide poussé pour créer un environnement propre, puis appliquez soigneusement la température pour contrôler le taux de dépôt.
- Si votre objectif principal est de traiter un matériau sensible à la chaleur : Tirez parti d'un vide poussé pour abaisser considérablement la température d'évaporation, évitant ainsi les dommages thermiques à la substance.
En fin de compte, maîtriser l'évaporation consiste à comprendre comment utiliser la température et la pression en concertation pour atteindre vos objectifs matériels spécifiques.
Tableau récapitulatif :
| Facteur | Effet sur l'évaporation | Principe clé |
|---|---|---|
| Température accrue | Augmente le taux d'évaporation | Fournit l'énergie cinétique nécessaire aux molécules pour s'échapper de la surface |
| Pression diminuée | Augmente le taux d'évaporation et la pureté | Élimine la résistance atmosphérique, abaisse le point d'ébullition |
Prêt à optimiser votre processus d'évaporation ?
Comprendre l'interaction entre la température et la pression est crucial pour obtenir des résultats précis dans votre laboratoire. Que vous ayez besoin de maximiser la pureté, de protéger les matériaux sensibles à la chaleur ou d'augmenter les taux de dépôt, disposer du bon équipement est essentiel.
KINTEK est spécialisée dans les équipements de laboratoire de haute qualité, y compris les systèmes de vide et les solutions thermiques, conçus pour vous donner un contrôle précis sur vos processus. Nos experts peuvent vous aider à choisir la configuration idéale pour votre application spécifique, garantissant efficacité, fiabilité et résultats supérieurs.
Contactez-nous dès aujourd'hui pour discuter de vos besoins et découvrir comment KINTEK peut améliorer les capacités de votre laboratoire !
Guide Visuel
Produits associés
- Presse à chaud sous vide hydraulique chauffée électriquement pour laboratoire
- Presse hydraulique chauffante avec plaques chauffantes pour presse à chaud de laboratoire sous vide
- Presse chauffante à double plaque pour laboratoire
- Presse hydraulique chauffante avec plaques chauffantes pour presse à chaud de laboratoire à boîte sous vide
- Four de Pressage à Chaud sous Vide Machine de Pressage sous Vide Chauffée
Les gens demandent aussi
- Comment les fours de précision automatisés influencent-ils l'évolution structurelle du Zr1Nb ? Maîtriser l'hydrogénation et la polygonisation
- Qu'est-ce qu'une machine de presse à chaud sous vide ? L'outil ultime pour la décoration de produits 3D
- Quelle est la fonction d'une presse thermique hydraulique ? Perfectionnement des membranes polymères pour batteries à état solide
- Comment réduire la porosité ? Atteindre une résistance et une densité maximales du matériau
- Que fait le pressage à chaud ? Transformer les matériaux par densification à haute température et haute pression



















