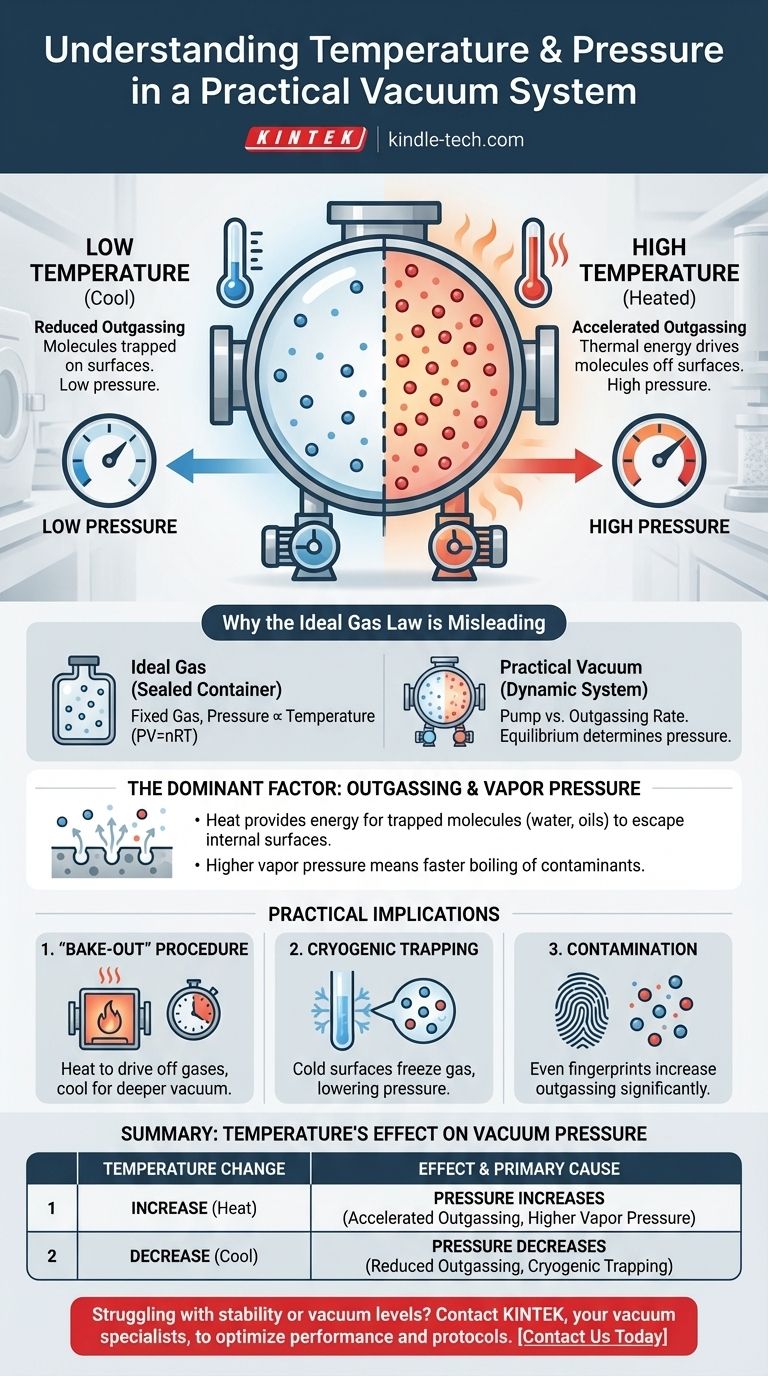
Dans un système à vide pratique, la relation est directe : augmenter la température du système augmentera la pression, dégradant ainsi la qualité du vide. Cela se produit parce que la chaleur fournit l'énergie nécessaire aux molécules piégées sur les surfaces internes de la chambre pour s'échapper dans l'espace de vide. Ce processus, connu sous le nom de dégazage, est la source dominante de pression dans les environnements à vide poussé.
La pression à l'intérieur d'une chambre à vide réelle n'est pas régie par la loi des gaz parfaits, mais par le taux de dégazage de ses surfaces internes. Des températures plus élevées augmentent ce taux, libérant plus de molécules de gaz et augmentant ainsi la pression globale.

Pourquoi la loi des gaz parfaits est trompeuse dans ce contexte
L'idée fausse d'un « gaz contenu »
La loi des gaz parfaits (PV=nRT) bien connue décrit la relation entre la pression, le volume et la température pour une quantité fixe de gaz dans un récipient scellé. Dans ce scénario, la pression est directement proportionnelle à la température.
Cependant, une chambre à vide n'est pas un récipient scellé contenant une quantité fixe de gaz. C'est un système dynamique où une pompe élimine activement les molécules. La principale source de ces nouvelles molécules est les surfaces internes de la chambre elle-même.
La réalité : un équilibre dynamique
La pression dans un vide est déterminée par l'équilibre entre la vitesse à laquelle la pompe élimine les molécules et la vitesse à laquelle de nouvelles molécules entrent dans le système. La principale source de ces nouvelles molécules est les surfaces internes de la chambre elle-même.
Le facteur dominant : le dégazage et la pression de vapeur
Qu'est-ce que le dégazage ?
Tous les matériaux ont des molécules de gaz adsorbées (collées à la surface) ou absorbées (piégées à l'intérieur du matériau). Dans un vide, ces molécules s'échapperont progressivement des surfaces.
Ce processus est appelé dégazage. Le principal coupable dans la plupart des systèmes à vide est la vapeur d'eau, mais les huiles, les solvants et les gaz piégés lors de la fabrication y contribuent également.
Comment la température provoque le dégazage
Le chauffage des parois de la chambre à vide transfère de l'énergie thermique aux molécules piégées. Cette énergie accrue leur permet de vaincre les forces qui les retiennent à la surface, provoquant leur libération dans le vide.
Une température plus élevée signifie un taux de dégazage nettement plus élevé, ce qui conduit directement à une pression plus élevée.
Le rôle de la pression de vapeur
Pour toute substance condensée, comme une gouttelette d'eau ou un film d'huile à l'intérieur de la chambre, il existe une pression de vapeur. C'est la pression à laquelle la substance est en équilibre avec son propre gaz à une température donnée.
À mesure que la température augmente, la pression de vapeur de ces contaminants augmente de façon exponentielle. Si la pression de vapeur du contaminant dépasse la pression dans la chambre, il se vaporisera rapidement, provoquant une augmentation spectaculaire de la pression.
Comprendre les implications pratiques
La procédure de « cuisson » (Bake-Out)
Les ingénieurs exploitent cette relation température-pression pour atteindre l'ultra-vide (UHV). Un système est chauffé, souvent à des centaines de degrés Celsius, pendant de nombreuses heures ou jours pendant que les pompes fonctionnent.
Cette « cuisson » accélère considérablement le dégazage, éliminant l'eau piégée et d'autres contaminants afin que les pompes puissent les éliminer de façon permanente. Une fois que le système est refroidi, le taux de dégazage est considérablement plus faible, permettant un vide beaucoup plus poussé.
L'impact de la cryogénie
L'effet inverse est également utilisé. Des surfaces extrêmement froides, appelées pièges cryogéniques ou cryopompes, agissent comme des puits pour les molécules de gaz.
Lorsqu'une molécule comme l'eau frappe une surface très froide, elle gèle instantanément et sa pression de vapeur devient négligeable. Cela l'élimine efficacement du vide, abaissant considérablement la pression du système.
Le problème de la contamination
Ce principe souligne pourquoi la propreté est primordiale dans la technologie du vide. Une seule empreinte digitale contient des huiles et de l'eau qui agiront comme une source importante de dégazage, limitant le vide ultime qu'un système peut atteindre, surtout lorsqu'il est chauffé.
Faire le bon choix pour votre objectif
Pour gérer efficacement un système à vide, vous devez considérer la température comme une variable de contrôle principale.
- Si votre objectif principal est d'atteindre le vide le plus poussé possible : Vous devez chauffer la chambre lors d'une « cuisson » tout en pompant pour forcer les gaz piégés à sortir, puis la laisser refroidir pour atteindre la pression cible.
- Si votre objectif principal est de maintenir un vide stable pendant un processus : Vous devez assurer un contrôle précis de la température, car même de petites fluctuations thermiques provoqueront des changements de pression dus aux variations des taux de dégazage.
- Si votre objectif principal est de traiter des substances à haute pression de vapeur : Vous devrez peut-être utiliser un refroidissement cryogénique (pièges froids) pour capturer les vapeurs et les empêcher de submerger vos pompes.
En fin de compte, maîtriser la pression dans votre système à vide signifie maîtriser l'énergie thermique de ses surfaces.
Tableau récapitulatif :
| Changement de température | Effet sur la pression du vide | Cause principale |
|---|---|---|
| Augmentation | La pression augmente | Dégazage accéléré et pression de vapeur plus élevée des contaminants. |
| Diminution | La pression diminue | Taux de dégazage réduit ; les surfaces cryogéniques peuvent piéger les molécules. |
Vous rencontrez des problèmes d'instabilité de pression ou vous n'arrivez pas à atteindre votre niveau de vide cible ? La gestion thermique de votre système est probablement la clé. KINTEK est spécialisé dans l'équipement de laboratoire et les consommables pour les applications de vide de précision. Nos experts peuvent vous aider à sélectionner les bons composants et à développer des protocoles de cuisson, de contrôle de la température ou de piégeage cryogénique pour garantir que vos processus sous vide sont fiables et reproductibles. Contactez nos spécialistes du vide dès aujourd'hui pour optimiser les performances de votre système.
Guide Visuel
Produits associés
- Presse hydraulique chauffante avec plaques chauffantes pour presse à chaud de laboratoire sous vide
- Presse à chaud sous vide hydraulique chauffée électriquement pour laboratoire
- Four de traitement thermique sous vide avec revêtement en fibre céramique
- Presse hydraulique manuelle chauffante haute température avec plaques chauffantes pour laboratoire
- Four de traitement thermique sous vide au molybdène
Les gens demandent aussi
- Quelles sont les précautions de sécurité pour le processus de traitement thermique ? Un guide pour gérer les risques thermiques, atmosphériques et liés aux équipements
- Comment l'utilisation d'une étuve de séchage sous vide affecte-t-elle les performances des cathodes LiMn2O4 (LMO) ? Améliorez la stabilité de la batterie
- Quelle est la fonction d'un four de test à haute température dans les essais sur l'acier RAFM ? Reproduire les conditions du réacteur nucléaire
- Comment fonctionne une machine de frittage ? Un guide de la métallurgie des poudres et de la fabrication céramique
- Quelle fonction un four d'infiltration de silicium remplit-il dans le collage SiC/SiC ? Optimiser l'infiltration de métal fondu réactif
- Quel four atteint la température la plus élevée ? Trouvez l'outil adapté à vos besoins en laboratoire ou dans l'industrie
- Comment un four de réduction sous vide facilite-t-il la séparation du magnésium du bore ? Maîtriser la pureté thermique
- Quelle température est nécessaire pour braser l'aluminium ? Maîtrisez la fenêtre thermique critique pour des joints solides



















