En substance, la calcination est un processus de traitement thermique fondamental en chimie. Il implique de chauffer un matériau solide à haute température, généralement en dessous de son point de fusion, dans une atmosphère contrôlée ou en l'absence d'air. Ceci est fait non pas pour faire fondre la substance, mais pour provoquer une décomposition thermique, éliminer les composants volatils comme l'eau et le dioxyde de carbone, ou déclencher une transition de phase dans sa structure cristalline.
L'objectif principal de la calcination n'est pas simplement de chauffer un matériau, mais de modifier fondamentalement sa composition chimique et sa structure physique d'une manière précise et contrôlée pour le rendre adapté à une application industrielle spécifique.

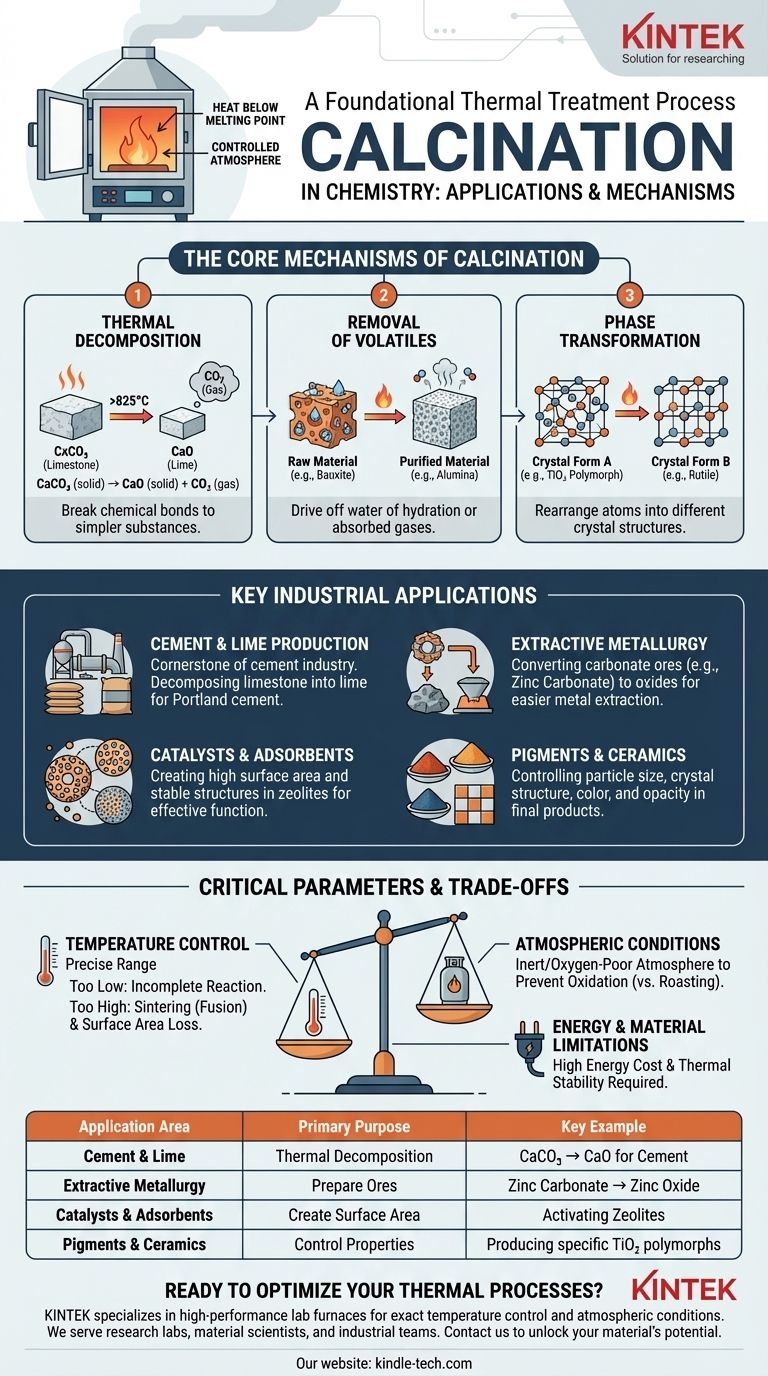
Les mécanismes fondamentaux de la calcination
Pour comprendre ses applications, vous devez d'abord saisir les changements fondamentaux que la calcination induit dans un matériau. Le processus atteint généralement l'un des trois objectifs principaux.
Décomposition thermique
C'est l'objectif le plus courant de la calcination. La chaleur appliquée fournit suffisamment d'énergie pour rompre les liaisons chimiques au sein d'un composé, le décomposant en substances plus simples.
L'exemple classique est la production de chaux (oxyde de calcium, CaO) à partir de calcaire (carbonate de calcium, CaCO₃). Le chauffage du calcaire au-dessus de 825°C élimine le dioxyde de carbone, laissant la chaux désirée.
CaCO₃ (solide) → CaO (solide) + CO₂ (gaz)
Élimination des volatils
De nombreuses matières premières contiennent des substances volatiles, le plus souvent de l'eau d'hydratation (eau chimiquement liée) ou des gaz absorbés.
La calcination purifie le matériau en éliminant ces volatils. Par exemple, le minerai de bauxite est calciné pour éliminer l'eau, convertissant les hydroxydes d'aluminium en oxyde d'aluminium (alumine), une étape critique avant la production de métal aluminium.
Transformation de phase
Le chauffage d'un solide peut amener ses atomes à se réarranger en une structure cristalline différente, un processus connu sous le nom de transition de phase. Les différentes formes cristallines (polymorphes) d'une substance peuvent avoir des propriétés physiques et chimiques très différentes.
Par exemple, la calcination est utilisée pour convertir le dioxyde de titane (TiO₂) en sa forme cristalline souhaitée (par exemple, rutile) pour une utilisation comme pigment, car cela contrôle son opacité et sa luminosité.
Applications industrielles clés
Les principes de la calcination sont appliqués dans de nombreuses industries à grande échelle où les propriétés des matériaux solides sont primordiales.
Production de ciment et de chaux
C'est l'application industrielle de la calcination la plus importante en volume. La décomposition du calcaire en chaux est la pierre angulaire de l'industrie du ciment, car la chaux est l'ingrédient principal du ciment Portland.
Métallurgie extractive
Avant qu'un métal puisse être extrait d'un minerai, le minerai doit souvent être préparé. La calcination est utilisée pour convertir les minerais carbonatés en leurs oxydes correspondants.
Il est généralement beaucoup plus facile et plus économe en énergie de réduire un oxyde métallique en métal pur que de réduire directement un carbonate métallique. Par exemple, le carbonate de zinc (smithsonite) est calciné en oxyde de zinc avant d'être fondu.
Catalyseurs et adsorbants
La performance des catalyseurs et des adsorbants (comme les zéolithes) dépend fortement de leur surface spécifique et de leur structure poreuse.
La calcination est une étape critique dans leur fabrication. Elle est utilisée pour éliminer les produits chimiques précurseurs, stabiliser le réseau du matériau et créer la surface élevée et les tailles de pores spécifiques nécessaires à leur fonctionnement efficace.
Pigments et céramiques
Dans la production de pigments inorganiques, de céramiques et de matériaux réfractaires, la calcination permet un contrôle précis des propriétés du produit final.
Le processus détermine la taille des particules, la structure cristalline et la pureté, ce qui a un impact direct sur des caractéristiques telles que la couleur, l'opacité, la dureté et la stabilité thermique.
Comprendre les compromis et les paramètres critiques
Bien que puissante, la calcination est un processus précis où de légers écarts peuvent entraîner des résultats indésirables. Le succès nécessite de gérer un équilibre attentif des facteurs.
Le contrôle de la température est primordial
La température de calcination est la variable la plus critique. Une température trop basse entraîne une réaction incomplète, laissant des impuretés ou du matériau de départ n'ayant pas réagi.
Inversement, une température trop élevée peut provoquer la frittage, où les particules solides commencent à fusionner. Cela réduit considérablement la surface du matériau, ce qui est catastrophique pour les applications impliquant des catalyseurs ou des adsorbants.
Les conditions atmosphériques comptent
La calcination est formellement définie par son atmosphère contrôlée, souvent inerte ou pauvre en oxygène. Cela la distingue de la grillage, qui est un processus similaire à haute température effectué en présence d'un excès d'air pour favoriser l'oxydation.
L'utilisation d'une atmosphère inerte (comme l'azote) empêche les réactions secondaires indésirables, garantissant que le matériau subit la décomposition ou le changement de phase souhaité sans être oxydé.
Limites énergétiques et matérielles
La calcination est un processus énergivore en raison des températures élevées requises. Cela représente un coût opérationnel important, en particulier à l'échelle industrielle.
De plus, elle n'est adaptée qu'aux matériaux qui sont thermiquement stables jusqu'à leur température de décomposition et qui ne fondent ni ne se vaporisent prématurément.
Faire le bon choix pour votre objectif
La calcination est un outil polyvalent, mais son application doit être adaptée au résultat souhaité.
- Si votre objectif principal est la production chimique en vrac : Utilisez la calcination pour la décomposition thermique à grande échelle, comme la conversion du calcaire en chaux pour le ciment.
- Si votre objectif principal est la préparation d'un minerai pour l'extraction de métal : Appliquez la calcination pour convertir les minerais carbonatés ou hydratés en leurs oxydes plus facilement réductibles.
- Si votre objectif principal est l'ingénierie des propriétés avancées des matériaux : Employez la calcination comme un outil de précision pour contrôler la structure cristalline et créer une surface élevée dans les catalyseurs, les pigments et les adsorbants.
En fin de compte, maîtriser la calcination consiste à comprendre comment appliquer une énergie thermique contrôlée pour libérer le potentiel chimique et physique précis caché dans un matériau solide.
Tableau récapitulatif :
| Domaine d'application | Objectif principal de la calcination | Exemple clé |
|---|---|---|
| Production de ciment et de chaux | Décomposition thermique des carbonates | Conversion du calcaire (CaCO₃) en chaux (CaO) pour le ciment |
| Métallurgie extractive | Préparer les minerais pour l'extraction de métal | Conversion du minerai de carbonate de zinc en oxyde de zinc avant la fusion |
| Catalyseurs et adsorbants | Créer une grande surface et une structure stable | Activation des zéolithes par élimination des précurseurs et stabilisation des pores |
| Pigments et céramiques | Contrôler la structure cristalline et les propriétés des particules | Production de polymorphes spécifiques de TiO₂ pour l'opacité et la couleur dans les pigments |
Prêt à optimiser vos processus thermiques ?
La calcination est une science précise, et l'équipement adéquat est essentiel pour obtenir les propriétés matérielles souhaitées, que vous développiez des catalyseurs, traitiez des minerais ou conceviez des céramiques avancées. KINTEK est spécialisé dans les fours de laboratoire haute performance et les équipements de traitement thermique conçus pour un contrôle précis de la température et des conditions atmosphériques, garantissant que vos processus de calcination sont efficaces, reproductibles et évolutifs.
Nous servons : Laboratoires de recherche, scientifiques des matériaux et équipes industrielles axées sur la métallurgie, la catalyse, la céramique et la production chimique.
Laissez-nous vous aider à libérer tout le potentiel de vos matériaux. Contactez nos experts dès aujourd'hui pour discuter de vos besoins spécifiques en matière de calcination et découvrir la solution idéale pour votre application.
Guide Visuel
Produits associés
- Fourneuse de pyrolyse de four rotatif électrique Machine calcineuse Petit four rotatif Four rotatif
- Petite usine de pyrolyse continue à four rotatif électrique pour le chauffage
- Four de régénération électrique pour charbon actif à four rotatif
- Four rotatif continu scellé sous vide Four rotatif
- Instrument de tamisage électromagnétique tridimensionnel
Les gens demandent aussi
- Peut-on utiliser la pyrolyse sur le plastique ? Libérez le potentiel du recyclage chimique
- Quels sont les composants d'une machine de pyrolyse ? Une analyse complète du système de valorisation énergétique des déchets
- Quel est le potentiel futur de la pyrolyse et de la gazéification ? Libérer de la valeur des déchets
- Comment fonctionne la pyrolyse rapide ? Convertir rapidement la biomasse en biocarburant liquide
- Quelles sont les réactions de pyrolyse de la biomasse ? Un guide pour convertir la biomasse en biochar, bio-huile et gaz de synthèse
- Quel est le but d'un réacteur de pyrolyse ? Transformer les déchets en bio-huile, biochar et syngaz de valeur
- À quoi peut servir la pyrolyse ? Transformer les déchets en carburant, en biochar et en gaz de synthèse
- Quels sont les types de matières premières pour le biochar ? Choisissez le bon matériau pour vos besoins



















