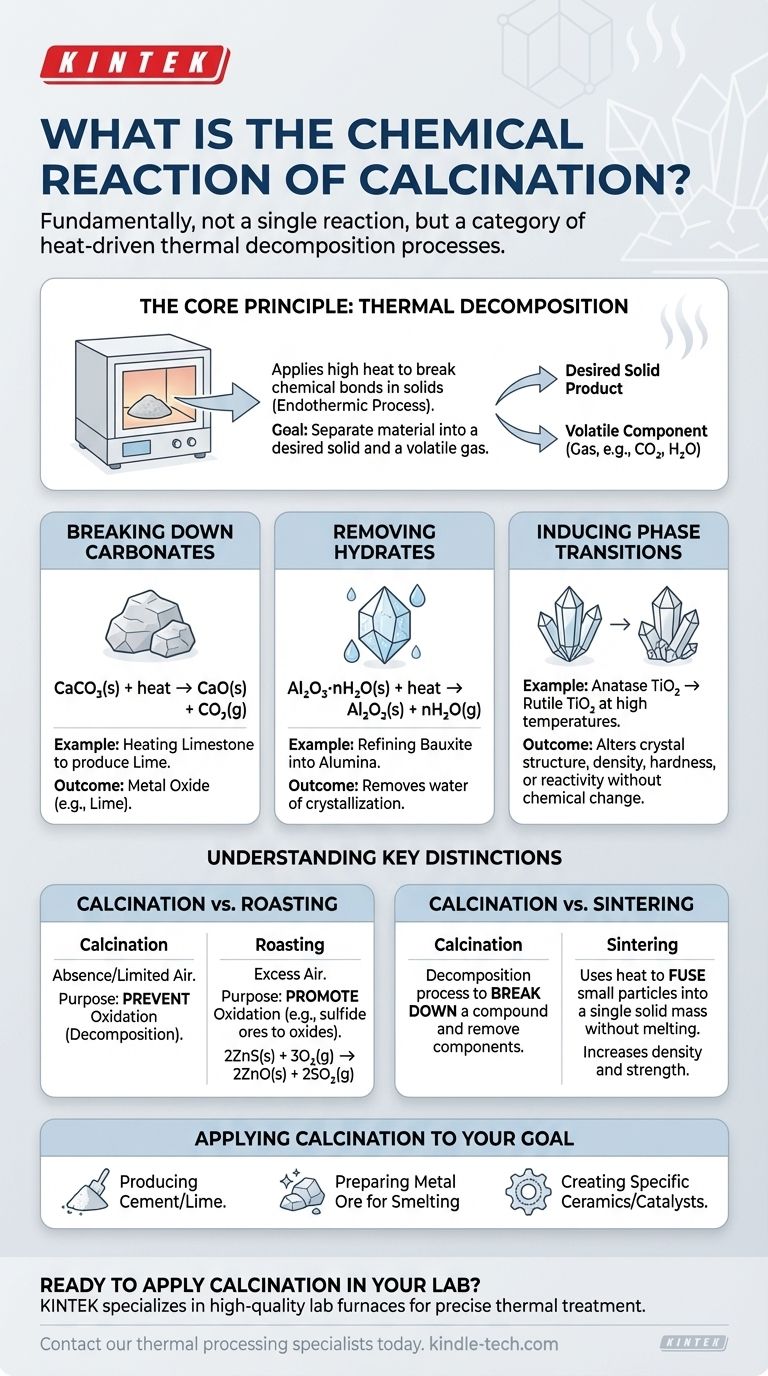
Fondamentalement, la calcination n'est pas une réaction chimique unique mais plutôt une catégorie de processus entraînés par la chaleur et définis par un résultat spécifique : la décomposition thermique. Bien que de nombreuses réactions relèvent de ce cadre, l'exemple le plus courant est la décomposition d'un carbonate, comme le chauffage du calcaire (carbonate de calcium) pour produire de la chaux (oxyde de calcium) et du dioxyde de carbone gazeux.
La calcination est un processus de traitement thermique qui utilise une chaleur élevée dans une atmosphère contrôlée pour décomposer un matériau. Son objectif principal est d'éliminer un composant volatil — comme le dioxyde de carbone ou l'eau — afin de purifier ou de modifier les propriétés chimiques et physiques du solide restant.

Le principe fondamental : la décomposition thermique
La calcination fonctionne en appliquant suffisamment d'énergie thermique à un solide pour rompre ses liaisons chimiques. Ce processus est toujours endothermique, ce qui signifie qu'il nécessite un apport d'énergie (chaleur) pour se produire. L'objectif est de séparer le matériau en un produit solide souhaité et un composant volatil qui peut être éliminé sous forme de gaz.
Décomposition des carbonates
C'est l'application classique et la plus répandue de la calcination, en particulier dans la production de ciment. Lorsqu'un carbonate métallique est chauffé, il se décompose en un oxyde métallique et en dioxyde de carbone gazeux.
Pour le calcaire, la réaction est la suivante :
CaCO₃(s) + chaleur → CaO(s) + CO₂(g)
Ici, le carbonate de calcium solide se décompose en oxyde de calcium solide (chaux) et en dioxyde de carbone gazeux.
Élimination des hydrates (eau de cristallisation)
De nombreux minéraux existent sous forme d'hydrates, ce qui signifie que des molécules d'eau sont incorporées dans leur structure cristalline. La calcination est utilisée pour éliminer cette eau, un processus souvent appelé « séchage », bien qu'il s'agisse d'une décomposition chimique.
Par exemple, le raffinage du minerai de bauxite en alumine implique la calcination de l'oxyde d'aluminium hydraté :
Al₂O₃·nH₂O(s) + chaleur → Al₂O₃(s) + nH₂O(g)
Cette étape élimine l'eau, concentrant l'oxyde d'aluminium, qui est un précurseur nécessaire à la production de métal aluminium.
Induction de transitions de phase
Moins fréquemment, la calcination peut désigner un processus où la chaleur ne provoque pas de décomposition mais modifie plutôt la structure cristalline (phase) d'un matériau. Cela modifie ses propriétés physiques, telles que la densité, la dureté ou la réactivité, sans changer sa formule chimique.
Un exemple est la conversion de l'anatase, une forme de dioxyde de titane (TiO₂), en sa phase rutile plus stable à haute température.
Comprendre les distinctions clés
L'utilité de la calcination devient plus claire lorsqu'elle est comparée à d'autres processus thermiques courants. Les conditions spécifiques — en particulier l'atmosphère — définissent le résultat.
Calcination par rapport au grillage
C'est la distinction la plus critique. La calcination se déroule en absence ou en quantité limitée d'air pour intentionnellement empêcher l'oxydation.
Le grillage, en revanche, est effectué en excès d'air spécifiquement pour favoriser l'oxydation. Il est généralement utilisé sur les minerais sulfurés, les convertissant en oxydes. Par exemple, le grillage du sulfure de zinc :
2ZnS(s) + 3O₂(g) → 2ZnO(s) + 2SO₂(g)
Calcination par rapport à la frittage
Ces processus ont des objectifs opposés. La calcination est un processus de décomposition utilisé pour décomposer un composé et éliminer un composant.
Le frittage, cependant, utilise la chaleur (en dessous du point de fusion) pour fusionner de petites particules en une seule masse solide. Il augmente la densité et la résistance, soudant essentiellement le matériau ensemble sans le faire fondre.
Appliquer la calcination à votre objectif
La réaction de calcination spécifique qui vous intéresse dépend entièrement de votre matériau de départ et du produit final souhaité.
- Si votre objectif principal est de produire du ciment ou de la chaux : Vous utilisez la calcination pour décomposer le carbonate de calcium en oxyde de calcium réactif.
- Si votre objectif principal est de préparer un minerai métallique pour la fusion : Vous utilisez probablement la calcination pour éliminer l'eau (des hydrates) ou le dioxyde de carbone (des carbonates) afin d'enrichir la teneur en métal.
- Si votre objectif principal est de créer une céramique ou un catalyseur spécifique : Vous utilisez peut-être la calcination pour obtenir une phase cristalline et une surface souhaitées dans un matériau comme l'alumine ou la titanie.
En fin de compte, la calcination est un outil fondamental en science des matériaux pour transformer des solides bruts en formes plus utiles, concentrées ou réactives.
Tableau récapitulatif :
| Type de réaction de calcination | Réaction exemple | Résultat clé |
|---|---|---|
| Décomposition du carbonate | CaCO₃(s) + chaleur → CaO(s) + CO₂(g) |
Produit un oxyde métallique (ex. : chaux) |
| Décomposition de l'hydrate | Al₂O₃·nH₂O(s) + chaleur → Al₂O₃(s) + nH₂O(g) |
Élimine l'eau de cristallisation |
| Transition de phase | TiO₂ anatase → TiO₂ rutile | Modifie la structure cristalline et les propriétés |
Prêt à appliquer la calcination dans votre laboratoire ?
Que vous développiez de nouveaux catalyseurs, traitiez des minerais ou synthétisiez des céramiques avancées, un traitement thermique précis est essentiel. KINTEK se spécialise dans les fours de laboratoire et l'équipement de haute qualité conçus pour des processus de calcination fiables.
Nous fournissons les outils dont vous avez besoin pour obtenir un chauffage uniforme, un contrôle précis de la température et des résultats constants. Laissez nos experts vous aider à choisir l'équipement adapté à votre matériau et à votre application spécifiques.
Contactez nos spécialistes en traitement thermique dès aujourd'hui pour discuter des exigences de votre projet et découvrir comment KINTEK peut améliorer votre recherche et développement.
Guide Visuel
Produits associés
- Fourneuse de pyrolyse de four rotatif électrique Machine calcineuse Petit four rotatif Four rotatif
- Petite usine de pyrolyse continue à four rotatif électrique pour le chauffage
- Four de régénération électrique pour charbon actif à four rotatif
- Four rotatif continu scellé sous vide Four rotatif
- Four tubulaire de traitement thermique rapide (RTP) de laboratoire
Les gens demandent aussi
- Qu'est-ce que le processus de pyrolyse thermique ? Un guide étape par étape du recyclage chimique
- Quel rôle joue un four rotatif dans le traitement par incinération des matériaux composites de déchets ? Energy & Volume Solutions
- Quels sont les matériaux utilisés dans le revêtement réfractaire des fours ? Choisissez le bon revêtement pour une durabilité maximale
- Quelle est l'efficacité thermique d'un four rotatif ? Atteignez des performances optimales avec la bonne méthode de chauffage
- À combien de degrés le four rotatif est-il chauffé ? Découvrez la clé de la température de votre procédé
- Quel est l'objectif d'un lit fluidisé ? Atteindre un transfert de chaleur et une efficacité de processus supérieurs
- Quels sont les paramètres d'un four rotatif ? Maîtriser le contrôle pour des résultats de processus optimaux
- La calcination produit-elle du CO2 ? Comprendre le rôle des carbonates dans la décomposition thermique



















