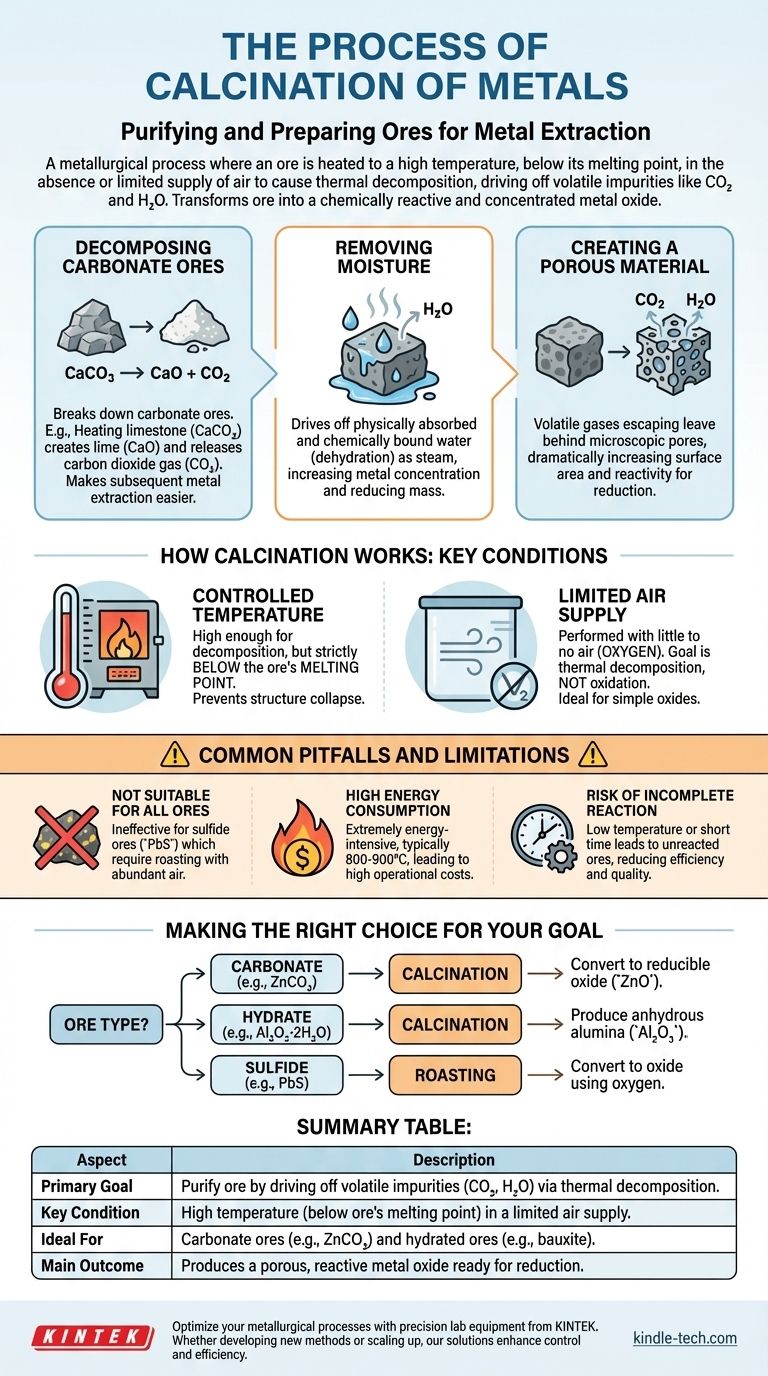
En termes simples, la calcination est un processus métallurgique au cours duquel un minerai est chauffé à haute température, en dessous de son point de fusion, en l'absence ou avec un apport très limité d'air. L'objectif principal n'est pas de faire fondre le minerai, mais de provoquer sa décomposition thermique, chassant les impuretés volatiles comme le dioxyde de carbone et l'eau. Cela purifie et prépare le minerai pour l'étape suivante de l'extraction du métal.
La fonction essentielle de la calcination est de transformer un minerai en une forme chimiquement plus réactive et concentrée — typiquement un oxyde métallique. En éliminant les composants volatils indésirables, elle rend le processus ultérieur de réduction du minerai en métal pur beaucoup plus efficace.

L'objectif principal de la calcination
La calcination est fondamentalement une étape préparatoire. Elle n'extrait pas le métal lui-même, mais rend le minerai plus apte à l'extraction en modifiant sa structure chimique et physique.
Décomposition des minerais carbonatés
De nombreux métaux importants, tels que le zinc et le calcium, se trouvent à l'état de minerais carbonatés dans la nature. La calcination les décompose.
Par exemple, le chauffage du calcaire (carbonate de calcium, CaCO3) produit de la chaux (oxyde de calcium, CaO) et libère du dioxyde de carbone gazeux (CO2). Il est beaucoup plus facile d'extraire le métal d'un oxyde que d'un carbonate.
Élimination de l'humidité
Les minerais extraits de la terre contiennent souvent des quantités importantes d'eau, à la fois physiquement absorbée et chimiquement liée (hydrates). Le chauffage du minerai pendant la calcination chasse cette eau sous forme de vapeur. Ce processus, appelé déshydratation, augmente la concentration du métal dans le minerai, réduisant ainsi la masse totale à traiter ultérieurement.
Création d'un matériau poreux
Un avantage essentiel, souvent négligé, de la calcination est le changement de la structure physique du minerai.
Lorsque des substances volatiles comme le CO2 et H2O s'échappent sous forme de gaz, elles laissent derrière elles des pores et des canaux microscopiques. Cela rend le matériau solide résultant beaucoup plus poreux, augmentant considérablement sa surface et le rendant plus réactif pour l'étape de réduction subséquente.
Comment fonctionne la calcination : conditions clés
Le succès de la calcination dépend entièrement du maintien d'un contrôle précis sur deux variables clés : la température et l'atmosphère.
Température contrôlée
La température doit être suffisamment élevée pour initier les réactions de décomposition souhaitées, mais doit rester strictement inférieure au point de fusion du minerai.
Si le minerai devait fondre, sa structure s'effondrerait, emprisonnant les impuretés et réduisant la surface, ce qui irait à l'encontre de l'objectif principal du processus.
Apport d'air limité
La calcination est intentionnellement réalisée avec peu ou pas d'air (oxygène). C'est une distinction cruciale avec un processus similaire appelé grillage.
L'objectif est de décomposer le composé par la chaleur seule, et non de l'oxyder. Empêcher l'oxydation garantit que le minerai est converti en un oxyde simple, qui est le matériau de départ idéal pour la réduction.
Pièges courants et limites
Bien qu'efficace, la calcination n'est pas une solution universelle et présente des exigences et des inconvénients spécifiques qui doivent être gérés.
Ne convient pas à tous les minerais
La calcination est spécifiquement conçue pour les minerais carbonatés et hydratés.
Elle est inefficace pour les minerais sulfurés (comme le sulfure de plomb, PbS). Ceux-ci nécessitent un grillage, un processus qui implique un chauffage en présence d'un excès d'air pour convertir le sulfure en oxyde.
Consommation énergétique élevée
Le chauffage de vastes quantités de minerai à des températures dépassant souvent 800-900°C est un processus extrêmement gourmand en énergie.
Cela entraîne des coûts opérationnels importants et une empreinte environnementale considérable, qui sont des facteurs majeurs dans la viabilité économique d'une opération minière.
Risque de réaction incomplète
Si la température est trop basse ou si le temps de chauffage est trop court, la réaction de décomposition peut ne pas être complète.
Cela laisse des carbonates ou des hydrates n'ayant pas réagi dans le produit final, réduisant l'efficacité de l'étape d'extraction ultérieure et potentiellement contaminant le métal final.
Faire le bon choix pour votre objectif
La sélection du traitement thermique approprié est la première décision critique dans la conception d'un flux de travail métallurgique efficace.
- Si votre minerai principal est un carbonate (par exemple, la smithsonite,
ZnCO3) : La calcination est l'étape essentielle pour le convertir en un oxyde métallique plus facilement réductible (ZnO). - Si votre minerai principal est un hydrate (par exemple, la bauxite,
Al2O3·2H2O) : La calcination est utilisée pour chasser l'eau chimiquement liée afin de produire de l'alumine anhydre (Al2O3). - Si votre minerai principal est un sulfure (par exemple, la galène,
PbS) : Vous devez utiliser le grillage, et non la calcination, pour convertir le minerai en oxyde en le faisant réagir avec l'oxygène.
En fin de compte, comprendre la calcination est essentiel pour saisir comment les minerais bruts et impurs sont méthodiquement préparés pour une extraction métallique efficace.
Tableau récapitulatif :
| Aspect | Description |
|---|---|
| Objectif principal | Purifier le minerai en chassant les impuretés volatiles (CO₂, H₂O) par décomposition thermique. |
| Condition clé | Haute température (en dessous du point de fusion du minerai) avec un apport d'air limité. |
| Idéal pour | Les minerais carbonatés (ex : ZnCO₃) et les minerais hydratés (ex : bauxite). |
| Résultat principal | Produit un oxyde métallique poreux et réactif prêt pour la réduction. |
Optimisez vos processus métallurgiques avec l'équipement de laboratoire de précision de KINTEK.
Que vous développiez une nouvelle méthode d'extraction ou que vous augmentiez la production, les bons outils sont essentiels pour contrôler la température et l'atmosphère lors d'étapes telles que la calcination. KINTEK est spécialisée dans les fours à haute température et les équipements de laboratoire conçus pour la fiabilité et la précision, aidant les laboratoires et les opérations minières à obtenir des résultats efficaces et constants.
Contactez nos experts dès aujourd'hui via notre formulaire de contact pour discuter de la manière dont nos solutions peuvent améliorer votre flux de travail d'extraction des métaux et vos résultats.
Guide Visuel
Produits associés
- Four à tube de laboratoire à haute température de 1400℃ avec tube en alumine
- Four à moufle haute température pour déliantage et pré-frittage en laboratoire
- Four à moufle de 1700℃ pour laboratoire
- Four à moufle de 1800℃ pour laboratoire
- Four à moufle de laboratoire à moufle à levage par le bas
Les gens demandent aussi
- Quels matériaux sont utilisés pour les tubes dans les fours tubulaires ? Un guide pour choisir le bon tube pour votre processus
- Comment un réacteur à tube de quartz et un four à atmosphère collaborent-ils dans la pyrolyse de Co@NC ? Maîtrisez la synthèse de précision
- Comment un four sous vide à tube de quartz contribue-t-il au processus de cristallisation des électrolytes Li-argyrodite dopés au Ag ?
- Comment nettoyer un four tubulaire ? Un guide étape par étape pour un entretien sûr et efficace
- Quelle est la valeur technique de l'utilisation d'une chambre de réaction à tube de quartz pour les tests de corrosion statique ? Obtenir de la précision.



















