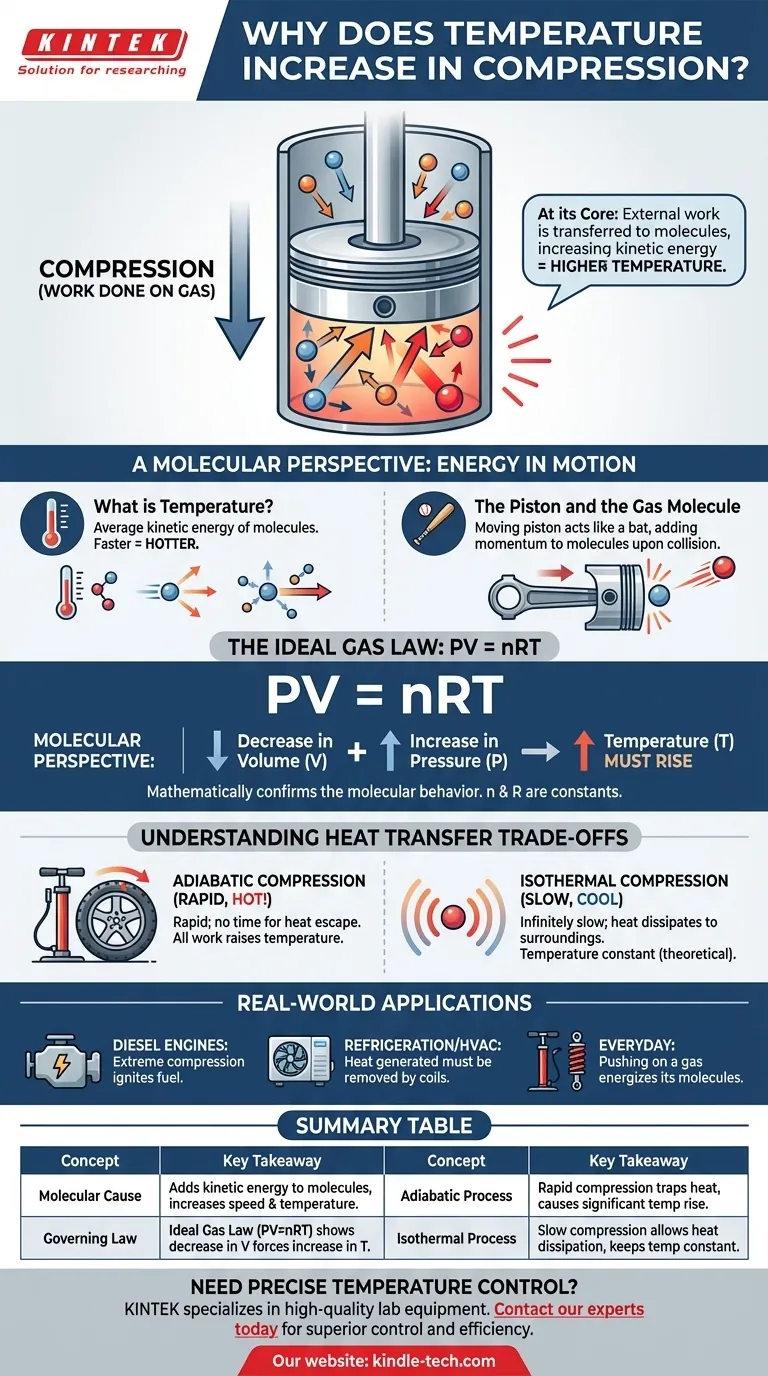
Au fond, comprimer un gaz augmente sa température parce que vous effectuez un travail sur lui. Ce travail externe est transféré directement aux molécules de gaz, augmentant leur énergie cinétique. Nous mesurons cette augmentation de l'énergie cinétique moyenne des molécules par une élévation de la température.
L'acte de compression n'est pas seulement une réduction de volume ; c'est une injection d'énergie. La force que vous appliquez pour comprimer le gaz ajoute de l'énergie à ses molécules, les faisant bouger plus vite, ce que nous percevons comme de la chaleur.

Une perspective moléculaire : l'énergie en mouvement
Pour vraiment comprendre le chauffage par compression, nous devons réfléchir à ce qui se passe à l'échelle des molécules individuelles. La température d'un gaz est simplement une mesure du mouvement moyen de ses innombrables particules.
Qu'est-ce que la température, en réalité ?
La température est une mesure macroscopique de l'énergie cinétique moyenne des molécules d'un système. Les molécules qui se déplacent plus vite possèdent plus d'énergie cinétique, ce qui entraîne une température plus élevée. Des molécules se déplaçant plus lentement signifient une température plus basse.
L'acte de compression
Imaginez un gaz contenu dans un cylindre avec un piston mobile. Pour comprimer le gaz, vous devez pousser physiquement le piston vers l'intérieur, en appliquant une force sur une distance. Cette action est la définition scientifique du travail.
Le piston et la molécule de gaz
Considérez le piston mobile comme une batte et une molécule de gaz comme une balle. Lorsqu'une molécule entre en collision avec un piston stationnaire, elle rebondit avec la même vitesse. Cependant, lorsqu'elle entre en collision avec un piston qui se déplace vers l'intérieur, le piston ajoute de l'élan et de l'énergie à la molécule, la faisant rebondir avec une vitesse plus grande.
L'effet collectif
Ce transfert d'énergie se produit des milliards de fois par seconde avec toutes les molécules frappant la face du piston. Chaque collision ajoute une petite quantité d'énergie. Le résultat cumulé est une augmentation significative de la vitesse moyenne — et donc de l'énergie cinétique moyenne — de toute la population de molécules, provoquant une augmentation de la température du gaz.
Le rôle de la loi des gaz parfaits
Ce comportement moléculaire est décrit mathématiquement par des lois physiques fondamentales, le plus simplement par la loi des gaz parfaits. Elle fournit une confirmation de haut niveau de ce que nous observons au niveau moléculaire.
L'équation directrice : PV = nRT
La loi des gaz parfaits relie la pression (P), le volume (V) et la température (T) d'une quantité donnée de gaz (n). Le « R » est une constante. Cette équation montre que ces propriétés sont intrinsèquement liées.
Comment la loi prédit le résultat
Lorsque vous comprimez un gaz, vous diminuez son volume (V). La force que vous appliquez augmente également sa pression (P). Pour que l'équation PV = nRT reste équilibrée, une augmentation du côté gauche de l'équation (due à la combinaison de l'augmentation de P et de la diminution de V) doit être compensée par une augmentation du côté droit. Puisque n et R sont constants, la température (T) doit augmenter.
Comprendre les compromis : le transfert de chaleur
La vitesse de compression modifie considérablement le résultat, car elle détermine le temps dont le système dispose pour interagir avec son environnement.
Compression adiabatique (aucune chaleur ne s'échappe)
Cela se produit lorsque la compression est si rapide qu'il n'y a pas le temps pour la chaleur générée de s'échapper dans l'environnement. Tout le travail que vous effectuez est converti directement en augmentation de l'énergie interne et de la température du gaz. Gonfler un pneu de vélo est un exemple concret proche ; la pompe devient nettement chaude.
Compression isotherme (fuite de chaleur parfaite)
C'est un idéal théorique qui se produit lorsque la compression est effectuée infiniment lentement. Ce rythme lent permet à toute la chaleur supplémentaire générée par le travail de se dissiper dans l'environnement, maintenant la température du gaz constante. Bien que cela ne soit pas pratiquement réalisable, c'est un concept critique pour l'analyse thermodynamique.
Le scénario du monde réel
Presque tous les processus du monde réel se situent entre ces deux extrêmes. Une partie du travail effectué augmente la température interne, tandis qu'une partie de la chaleur générée est perdue dans l'environnement.
Comment appliquer ce principe
Comprendre le chauffage par compression n'est pas seulement académique ; c'est fondamental pour d'innombrables applications et systèmes du monde réel.
- Si votre objectif principal concerne les phénomènes quotidiens : rappelez-vous que pousser sur un gaz (faire un travail) énergise ses molécules, c'est pourquoi une pompe à vélo ou un amortisseur devient chaud.
- Si votre objectif principal est la conception de moteurs : ce principe est le fondement même du moteur diesel, qui utilise une compression extrême pour chauffer l'air suffisamment pour enflammer le carburant sans bougie d'allumage.
- Si votre objectif principal est la réfrigération ou le CVC : la chaleur générée pendant la phase de compression d'un réfrigérant est la chaleur perdue qui doit être activement éliminée par les serpentins du condenseur à l'arrière de votre réfrigérateur ou dans votre unité de climatisation extérieure.
En fin de compte, le lien entre le travail mécanique et l'énergie thermique est une loi fondamentale de la physique, transformant la force en chaleur au niveau moléculaire.
Tableau récapitulatif :
| Concept | Idée clé |
|---|---|
| Cause moléculaire | La compression ajoute de l'énergie cinétique aux molécules de gaz, augmentant leur vitesse et leur température. |
| Loi directrice | La loi des gaz parfaits (PV=nRT) montre mathématiquement qu'une diminution du volume (V) force une augmentation de la température (T). |
| Processus adiabatique | La compression rapide (ex. : pompe à vélo) emprisonne la chaleur, provoquant une élévation significative de la température. |
| Processus isotherme | La compression lente et théorique permet à la chaleur de se dissiper, maintenant la température constante. |
| Impact sur le monde réel | Fondamental pour les moteurs diesel, les cycles de réfrigération et les systèmes CVC. |
Besoin d'un contrôle précis de la température pour vos processus ? Les principes de la thermodynamique sont essentiels pour la R&D et les applications industrielles. KINTEK est spécialisée dans les équipements de laboratoire et les consommables de haute qualité, répondant aux besoins exigeants des laboratoires. Que vous développiez de nouveaux matériaux ou optimisiez des systèmes thermiques, notre expertise peut soutenir votre travail. Contactez nos experts dès aujourd'hui pour discuter de la manière dont nous pouvons vous aider à obtenir un contrôle et une efficacité supérieurs dans votre laboratoire.
Guide Visuel
Produits associés
- Presse isostatique à chaud WIP Station de travail 300 MPa pour applications haute pression
- Presse chauffante à double plaque pour laboratoire
- Moule de presse anti-fissuration pour usage en laboratoire
- Machine de comprimé à poinçon unique et machine de comprimé rotative pour la production de masse pour TDP
- Presse à comprimés électrique à poinçon unique, laboratoire, poudre, poinçonnage TDP
Les gens demandent aussi
- Comment un système d'homogénéisation par ultrasons perturbe-t-il les structures cellulaires végétales ? Améliorez l'extraction grâce à la cavitation acoustique
- L'inhalation de nanotubes de carbone est-elle toxique ? Comprendre les risques de type amiante des nanotubes longs et rigides
- Un incubateur peut-il être utilisé pour le séchage ? Évitez d'endommager vos échantillons et votre équipement
- Quelle est la température de brasage CVC ? Maîtrisez le joint parfait pour des systèmes étanches
- Quelle est la taille du spot XRF ? Choisissez la bonne taille pour votre analyse
- Quelles sont les exigences pour les matériaux réfractaires ? Choisissez le bon matériau pour la chaleur extrême
- Quel est l'objectif de l'utilisation de l'argon pendant le processus de pulvérisation cathodique ? Permettre un dépôt de couches minces efficace
- Qu'est-ce qu'un équipement de pulvérisation cathodique ? Dépôt de couches minces de précision pour la fabrication de haute technologie



















