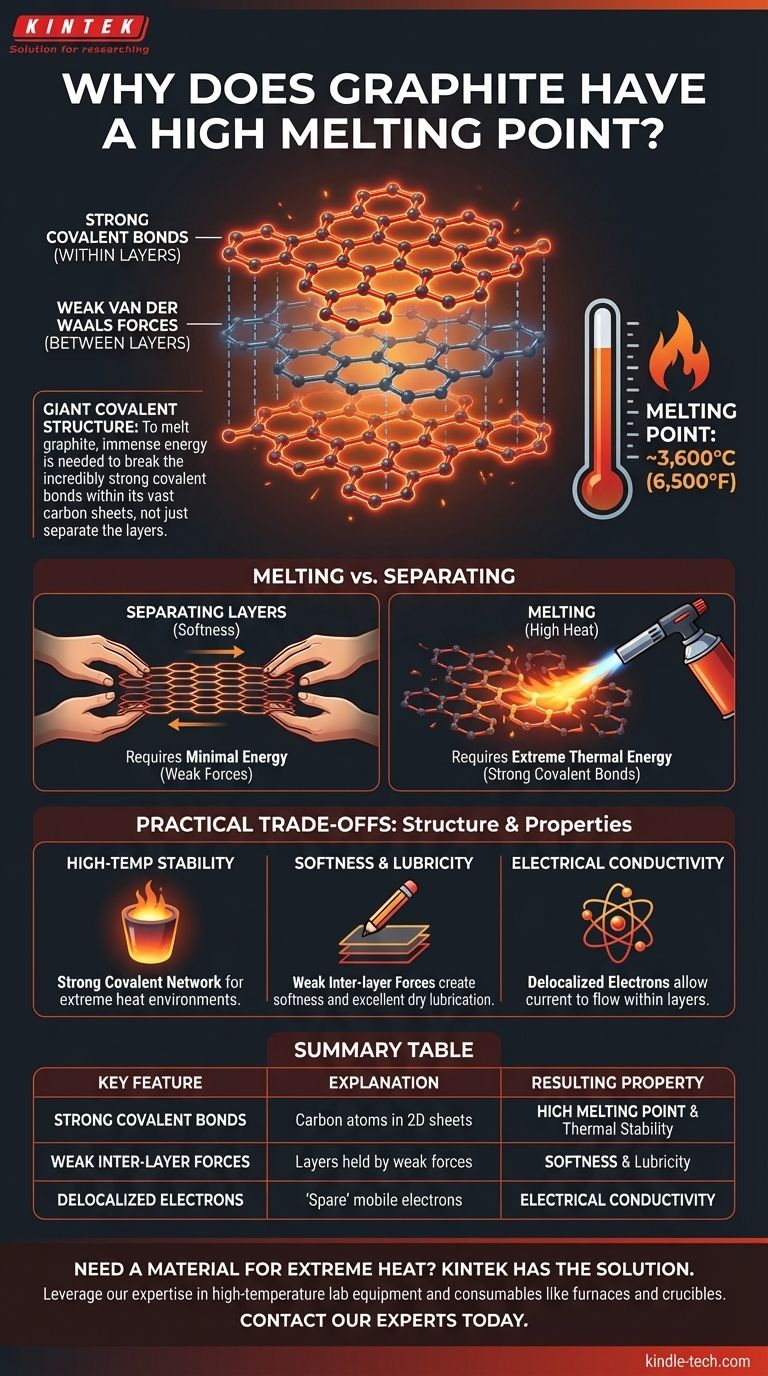
Fondamentalement, le point de fusion exceptionnellement élevé du graphite (environ 3 600 °C ou 6 500 °F) est le résultat direct de sa structure atomique. Pour faire fondre le graphite, il faut fournir une quantité énorme d'énergie pour rompre les liaisons covalentes incroyablement fortes qui relient ses atomes de carbone en de vastes feuilles bidimensionnelles.
L'idée cruciale est que le graphite est une structure covalente géante. Le faire fondre ne signifie pas simplement faire glisser ses couches l'une sur l'autre ; cela signifie déchirer le réseau puissant de liaisons carbone-carbone à l'intérieur de ces couches, un processus qui nécessite une énergie thermique extrême.

L'architecture bidimensionnelle du graphite
Pour comprendre le point de fusion élevé, il faut d'abord visualiser les deux types de liaisons distincts du graphite, qui lui confèrent une combinaison unique de propriétés.
Les couches covalentes solides
Le graphite est composé d'innombrables couches d'atomes de carbone. Au sein de chaque couche individuelle, chaque atome de carbone est lié à trois autres atomes de carbone par de fortes liaisons covalentes.
Ces atomes s'organisent en un motif en nid d'abeille de cycles hexagonaux interconnectés. Cela crée une feuille vaste, plate et exceptionnellement stable, connue sous le nom de graphène.
Les forces inter-couches faibles
Bien que les liaisons à l'intérieur d'une couche soient immensément fortes, les forces qui maintiennent les différentes couches ensemble sont très faibles.
Ces forces sont connues sous le nom de forces de van der Waals. Elles sont facilement surmontées, ce qui permet aux couches de glisser les unes sur les autres avec un effort minimal. C'est ce qui confère au graphite sa douceur caractéristique et en fait un excellent lubrifiant sec.
Pourquoi cette structure exige-t-elle une chaleur extrême
La clé du point de fusion élevé du graphite réside dans la compréhension de ce que signifie réellement « fondre » pour une structure covalente géante.
Fusion contre Séparation
Faire fondre une substance nécessite de rompre les liaisons qui maintiennent ses atomes ou molécules dans un réseau fixe, leur permettant de se déplacer librement à l'état liquide.
Pour le graphite, ce processus ne consiste pas à surmonter les faibles forces de van der Waals entre les couches. Il s'agit de fournir suffisamment d'énergie pour rompre les fortes liaisons covalentes au sein des couches elles-mêmes.
L'énergie pure des liaisons covalentes
Les liaisons covalentes, où les atomes partagent des électrons, sont parmi les formes de liaison chimique les plus fortes. Chaque liaison carbone-carbone dans le graphite est exceptionnellement stable et nécessite un apport thermique massif pour être rompue.
Étant donné qu'un morceau de graphite contient un nombre colossal de ces liaisons, une température extrêmement élevée est nécessaire pour en rompre suffisamment afin de faire passer l'ensemble de la structure à l'état liquide.
Comprendre les compromis pratiques
La nature à double liaison du graphite crée un matériau de contrastes. Ses propriétés dépendent fortement de l'aspect de sa structure qui est testé.
Stabilité à haute température
Le réseau de fortes liaisons covalentes fait du graphite l'un des matériaux les plus stables thermiquement connus. C'est pourquoi il est utilisé pour des applications telles que les creusets industriels pour la fusion des métaux et comme revêtement pour les fours à haute température.
Douceur mécanique et lubrification
Inversement, les forces faibles entre les couches rendent le graphite mécaniquement tendre et excellent lubrifiant. Les couches se cisaillent facilement, ce qui est le principe derrière un crayon de graphite laissant une marque sur le papier.
Conductivité électrique
La même structure de liaison qui assure la stabilité thermique permet également au graphite de conduire l'électricité. Chaque atome de carbone possède un électron délocalisé « de rechange » libre de se déplacer le long du plan de la couche, permettant au courant de circuler. C'est une propriété rare pour un non-métal.
Comment appliquer cela à votre objectif
Comprendre cette relation structure-propriété est essentiel pour sélectionner le bon matériau pour une application.
- Si votre objectif principal est la résistance thermique : Le réseau covalent géant du graphite en fait un choix de premier ordre pour les environnements à haute température où l'intégrité structurelle sous la chaleur est primordiale.
- Si votre objectif principal est la lubrification ou la douceur : Les faibles forces inter-couches sont la propriété clé, rendant le graphite idéal pour les lubrifiants secs ou les instruments d'écriture.
- Si votre objectif principal est la conductivité électrique dans un matériau léger : Les électrons mobiles du graphite offrent une solution conductrice sans le poids de la plupart des métaux.
En fin de compte, le point de fusion élevé du graphite est une conséquence directe de l'immense force des liaisons chimiques qui maintiennent sa structure fondamentale unie.
Tableau récapitulatif :
| Caractéristique clé | Explication | Propriété résultante |
|---|---|---|
| Liaisons covalentes fortes | Les atomes de carbone forment de fortes liaisons covalentes en feuilles 2D (graphène). | Point de fusion élevé et stabilité thermique |
| Forces inter-couches faibles | Les couches sont maintenues par de faibles forces de van der Waals. | Douceur et lubrification |
| Électrons délocalisés | Les électrons « de rechange » peuvent se déplacer librement à l'intérieur des couches. | Conductivité électrique |
Besoin d'un matériau pour des chaleurs extrêmes ? KINTEK a la solution.
Comprendre les propriétés de matériaux comme le graphite est crucial pour sélectionner l'équipement de laboratoire adapté à vos besoins. Que vous ayez besoin de fours à haute température avec des éléments en graphite, de creusets durables ou d'autres équipements de laboratoire conçus pour résister à des conditions extrêmes, l'expertise de KINTEK est votre avantage.
Nous nous spécialisons dans la fourniture d'équipements et de consommables de laboratoire fiables qui tirent parti des propriétés uniques des matériaux avancés. Laissez-nous vous aider à atteindre précision et durabilité dans vos applications à haute température.
Contactez nos experts dès aujourd'hui pour discuter de la manière dont nos solutions peuvent répondre aux besoins spécifiques de votre laboratoire.
Guide Visuel
Produits associés
- Grand four de graphitisation sous vide vertical en graphite
- Four de graphitation continue sous vide de graphite
- Four de graphitisation sous vide vertical à haute température
- Four de graphitation à décharge par le bas pour matériaux en graphite pour matériaux carbonés
- Four de graphitation sous vide à ultra-haute température au graphite
Les gens demandent aussi
- Comment un four à haute température contribue-t-il au traitement thermique post-synthèse des composites Fe-Cr-Mn-Mo-N-C ?
- Quels sont les défis de l'utilisation à grande échelle de l'énergie de la biomasse ? Les obstacles cachés à une source d'énergie verte
- Une teneur élevée en cendres est-elle une bonne chose ? Un guide pour comprendre les niveaux de minéraux dans les aliments pour animaux de compagnie
- Une capacité thermique élevée signifie-t-elle un point de fusion élevé ? Démêler la différence critique
- Quel rôle joue un four de laboratoire à haute température dans le PHT ? Ingénieur Durabilité des revêtements à l'échelle nanométrique



















