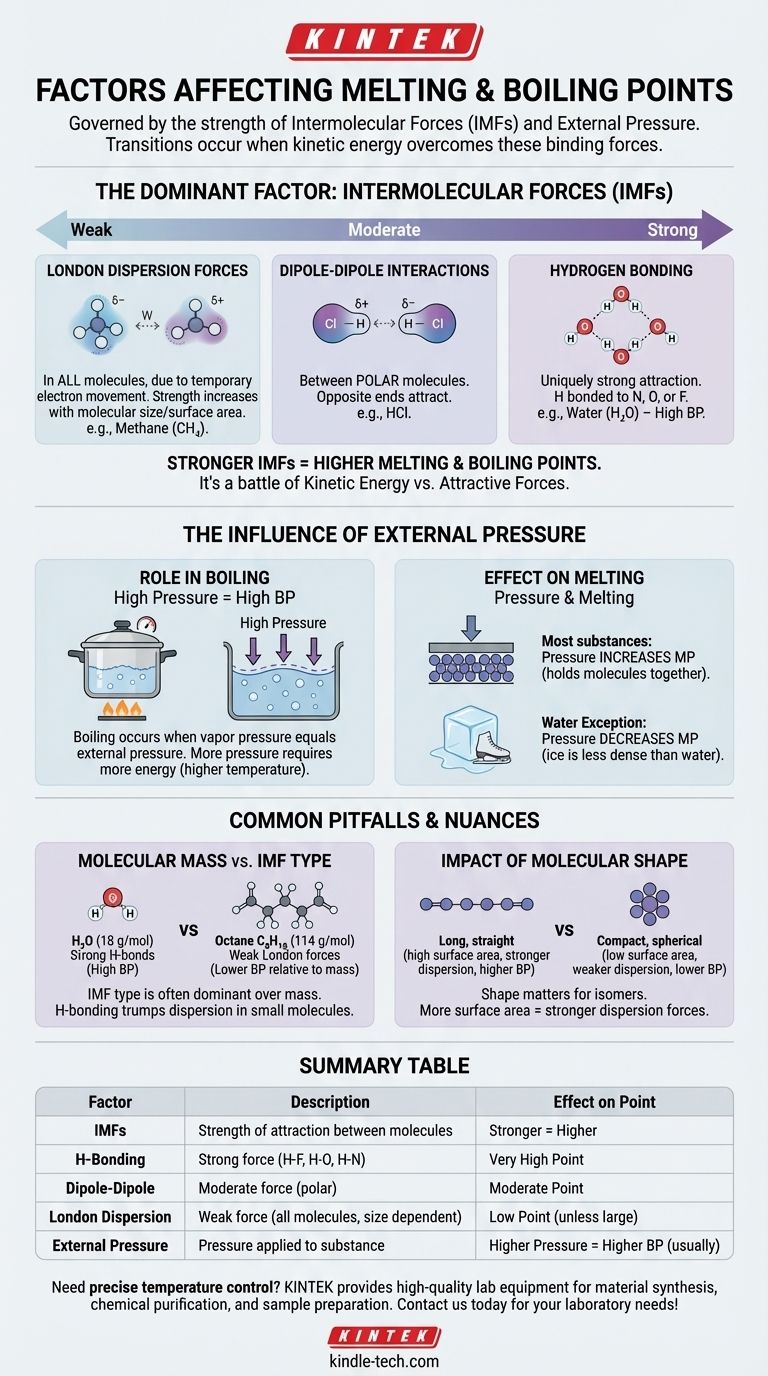
À un niveau fondamental, les points de fusion et d'ébullition d'une substance sont régis par deux facteurs principaux : la force des forces intermoléculaires (FIM) qui maintiennent ses molécules ensemble et la pression externe qui lui est appliquée. Essentiellement, ces transitions se produisent lorsque les molécules acquièrent suffisamment d'énergie pour surmonter les forces qui les lient et la pression qui les contient.
Le principal enseignement est que la fusion et l'ébullition ne sont pas seulement une question de température ; elles sont une bataille physique entre l'énergie cinétique d'une molécule et les forces attractives qui la retiennent à ses voisines. Plus ces attractions sont fortes, plus il faut d'énergie pour les séparer.

Le facteur dominant : les forces intermoléculaires (FIM)
Le facteur le plus important pour déterminer les points de fusion et d'ébullition d'une substance est la force des attractions entre ses molécules individuelles. Il ne s'agit pas des fortes liaisons covalentes au sein d'une molécule, mais des forces plus faibles qui font que les molécules adhèrent les unes aux autres.
Que sont les forces intermoléculaires ?
Considérez les FIM comme l'équivalent moléculaire des aimants. Certaines molécules sont comme de puissants électroaimants, tandis que d'autres sont comme de faibles aimants de réfrigérateur. Surmonter cette "adhérence" nécessite de l'énergie sous forme de chaleur.
La hiérarchie des forces
Les forces intermoléculaires varient en force, créant une hiérarchie claire. Comprendre cette hiérarchie est essentiel pour prédire quelles substances auront des points d'ébullition plus élevés ou plus bas.
Liaison hydrogène (la plus forte) Il s'agit d'un type d'attraction particulièrement fort qui se produit lorsque l'hydrogène est lié à un atome très électronégatif comme l'azote (N), l'oxygène (O) ou le fluor (F). L'eau (H₂O) en est l'exemple classique, et ses puissantes liaisons hydrogène expliquent pourquoi elle a un point d'ébullition si remarquablement élevé pour sa petite taille.
Interactions dipôle-dipôle (modérées) Ces forces existent entre les molécules polaires – des molécules qui ont une charge partielle positive permanente à une extrémité et une charge partielle négative à l'autre. Ces extrémités opposées s'attirent mutuellement, maintenant la substance assez bien ensemble.
Forces de dispersion de London (les plus faibles) Ces forces existent dans toutes les molécules, causées par le mouvement temporaire et aléatoire des électrons qui crée des dipôles éphémères. Bien que faibles individuellement, elles deviennent plus significatives à mesure que la taille et la surface de la molécule augmentent. C'est pourquoi les molécules plus grandes comme l'octane (C₈H₁₈) sont liquides à température ambiante, tandis que les plus petites comme le méthane (CH₄) sont des gaz.
L'influence de la pression externe
La pression externe agit comme un couvercle physique sur une substance, rendant plus difficile pour les molécules de s'échapper vers la phase suivante (du solide au liquide, ou du liquide au gaz).
Le rôle de la pression dans l'ébullition
L'ébullition se produit lorsque la pression de vapeur interne d'un liquide est égale à la pression atmosphérique externe.
Si vous augmentez la pression externe (par exemple, en utilisant une cocotte-minute), vous augmentez le point d'ébullition car les molécules ont besoin de plus d'énergie pour s'opposer à cette force externe plus forte.
Inversement, si vous diminuez la pression externe (par exemple, en allant à haute altitude), vous abaissez le point d'ébullition. C'est pourquoi l'eau bout à une température plus basse à Denver qu'au niveau de la mer.
L'effet de la pression sur la fusion
Pour la plupart des substances, l'augmentation de la pression augmente légèrement le point de fusion. C'est parce que la pression aide à maintenir les molécules dans la structure rigide et compacte d'un solide.
L'eau est une exception célèbre. Parce que la glace solide est moins dense que l'eau liquide, l'application de pression la rend en fait plus facile à faire fondre. C'est pourquoi la lame d'un patineur peut glisser sur la glace.
Pièges courants et nuances
Se contenter d'examiner un seul facteur peut être trompeur. L'interaction entre les forces, la masse et la forme crée d'importantes nuances.
Masse moléculaire vs. force intermoléculaire
Bien que les points d'ébullition augmentent généralement avec la masse molaire, le type de FIM est bien plus dominant.
Une petite molécule avec de fortes liaisons hydrogène, comme l'eau (18 g/mol, bout à 100°C), aura un point d'ébullition bien plus élevé qu'une molécule de taille similaire avec seulement de faibles forces de dispersion, comme le méthane (16 g/mol, bout à -161,5°C).
L'impact de la forme moléculaire
Pour les molécules ayant la même formule chimique (isomères), la forme compte. Les molécules longues et droites ont une plus grande surface de contact, ce qui entraîne des forces de dispersion de London plus fortes et des points d'ébullition plus élevés.
Les molécules compactes et sphériques ont une surface de contact plus petite et donc des attractions plus faibles et des points d'ébullition plus bas.
Faire la bonne prédiction
En combinant ces principes, vous pouvez évaluer avec précision pourquoi différentes substances se comportent de la manière dont elles le font.
- Si votre objectif principal est de comparer différentes substances : Identifiez d'abord la force intermoléculaire la plus forte présente dans chacune ; ce sera presque toujours le principal déterminant de leurs points d'ébullition relatifs.
- Si votre objectif principal est de modifier les conditions d'une substance : Analysez comment les changements de pression externe auront un impact sur l'énergie requise pour une transition de phase, en particulier pour l'ébullition.
- Si vous rencontrez un résultat inattendu : Considérez des facteurs secondaires comme la forme moléculaire ou les propriétés de densité uniques de la substance, comme on le voit avec l'eau.
En comprenant ces principes fondamentaux, vous pouvez passer de la simple mémorisation des points de fusion et d'ébullition à une véritable compréhension du comportement physique de la matière.
Tableau récapitulatif :
| Facteur | Description | Effet sur le point de fusion/ébullition |
|---|---|---|
| Forces intermoléculaires (FIM) | Force d'attraction entre les molécules. | Forces plus fortes = Point plus élevé |
| Liaison hydrogène | Force forte avec les liaisons H-F, H-O, H-N. | Point très élevé |
| Dipôle-dipôle | Force modérée entre les molécules polaires. | Point modéré |
| Dispersion de London | Force faible dans toutes les molécules, augmente avec la taille. | Point bas (sauf si la molécule est grande) |
| Pression externe | Pression appliquée à la substance. | Pression plus élevée = Point d'ébullition plus élevé (généralement) |
Besoin d'un contrôle précis de la température pour vos processus de laboratoire ? Comprendre les transitions de phase est essentiel pour des applications telles que la synthèse de matériaux, la purification chimique et la préparation d'échantillons. Chez KINTEK, nous sommes spécialisés dans les équipements de laboratoire de haute qualité, y compris les fours, les étuves et les systèmes de contrôle de la température, conçus pour offrir la précision et la fiabilité que votre recherche exige. Laissez nos experts vous aider à sélectionner l'équipement parfait pour votre application spécifique. Contactez-nous dès aujourd'hui pour discuter de vos besoins en laboratoire !
Guide Visuel
Produits associés
- Four de traitement thermique sous vide et four de fusion par induction à lévitation
- Système de fusion par induction sous vide pour la fabrication de bandes et de fils
- Four de Fusion par Induction sous Vide à l'Échelle du Laboratoire
- Presse hydraulique chauffante automatique avec plaques chauffantes pour presse à chaud de laboratoire 25T 30T 50T
- Presse hydraulique chauffante avec plaques chauffantes manuelles intégrées pour utilisation en laboratoire
Les gens demandent aussi
- Quelles sont les parties d'un four sous vide ? Un guide des 5 systèmes principaux
- Comment fonctionne le traitement thermique ? Adaptez les propriétés des matériaux à votre application
- Qu'est-ce que le processus de trempe sous vide ? Obtenez une dureté supérieure avec une finition de surface impeccable
- Quels sont les quatre types de processus de traitement thermique ? Recuit, Normalisation, Trempe et Revenu.
- Pourquoi traiter thermiquement sous vide ? Obtenir une finition de surface parfaite et une intégrité matérielle






















