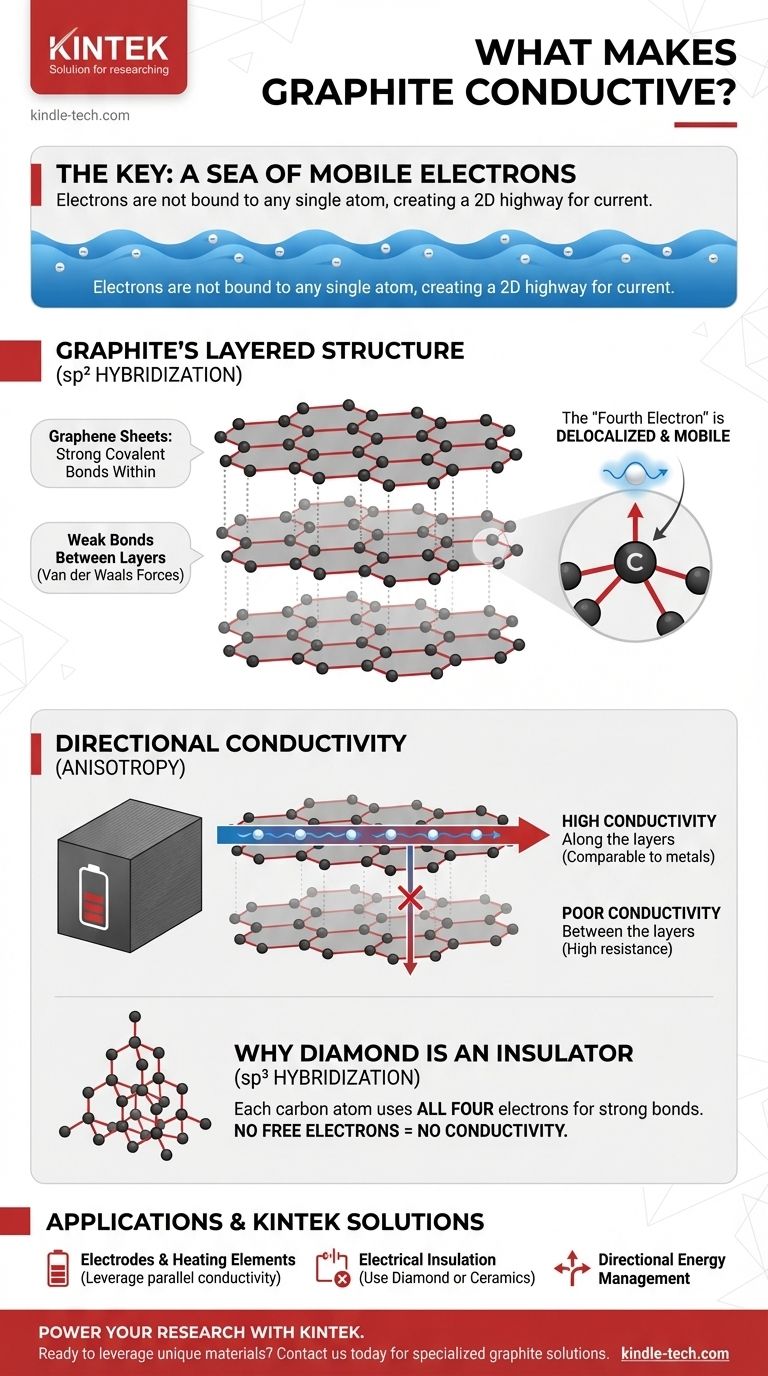
À la base, la conductivité électrique du graphite est due à une mer d'électrons mobiles qui ne sont liés à aucun atome unique. Ce comportement électronique unique est une conséquence directe de la structure atomique en couches spécifique du graphite et de la manière dont ses atomes de carbone se lient entre eux.
L'idée cruciale est que, si la plupart des non-métaux bloquent leurs électrons en place, la structure unique en feuillets du graphite laisse un électron par atome libre de se déplacer. Cet électron "délocalisé" crée une autoroute électronique bidimensionnelle, permettant au graphite de conduire l'électricité à la manière d'un métal.

Le fondement : la structure en couches du graphite
Pour comprendre le flux d'électricité, nous devons d'abord visualiser la forme physique du matériau. Le graphite n'est pas un mélange aléatoire d'atomes ; c'est un cristal hautement organisé.
Une pile de feuilles de graphène
Le graphite est composé d'innombrables couches d'atomes de carbone. Chaque couche individuelle, connue sous le nom de feuille de graphène, est un plan plat et bidimensionnel.
Liaisons fortes à l'intérieur, liaisons faibles entre
Au sein de chaque feuille, les atomes de carbone sont disposés selon un motif hexagonal en nid d'abeille, connectés par des liaisons covalentes extrêmement fortes. Cependant, les liaisons qui maintiennent les feuilles séparées sont très faibles (forces de van der Waals).
Le rôle de l'électron : libérer la conductivité
La nature spécifique des liaisons au sein des feuilles de graphène est la véritable source de la conductivité du graphite.
La liaison d'hybridation sp²
Chaque atome de carbone possède quatre électrons de la couche externe disponibles pour la liaison. Dans le graphite, chaque atome utilise trois de ces électrons pour former des liaisons fortes et planes avec ses trois voisins dans la feuille hexagonale.
Le "quatrième électron" crée une mer de mobilité
Il reste ainsi un électron par atome de carbone qui n'est pas impliqué dans le cadre de liaison primaire. Cet électron occupe un type d'orbitale différent (orbitale p) et n'est plus lié à son atome d'origine.
Au lieu de cela, ces "quatrièmes électrons" de tous les atomes d'une feuille fusionnent pour former une mer d'électrons délocalisés. Ces électrons sont libres de se déplacer n'importe où sur toute la surface bidimensionnelle de leur feuille de graphène.
Comment les électrons mobiles permettent le courant
Le courant électrique est simplement le flux de charge. Lorsqu'une tension est appliquée à un morceau de graphite, cette vaste réserve d'électrons mobiles est facilement poussée le long des feuilles de graphène, créant un puissant courant électrique.
Comprendre les compromis : la conductivité directionnelle
La conductivité du graphite n'est pas uniforme dans toutes les directions. Cette propriété, connue sous le nom d'anisotropie, est une considération critique dans toute application pratique.
Haute conductivité le long des couches
L'électricité circule exceptionnellement bien parallèlement aux feuilles de graphène. La mer d'électrons délocalisés offre un chemin presque dégagé pour le courant, ce qui rend la conductivité du graphite dans cette direction comparable à celle de nombreux métaux.
Faible conductivité entre les couches
En revanche, il est très difficile pour les électrons de sauter d'une feuille à l'autre. Le grand écart et les forces faibles entre les couches créent une résistance élevée, faisant du graphite un mauvais conducteur perpendiculairement à ses couches.
Pourquoi le diamant n'est-il pas conducteur ? Une comparaison clé
Pour apprécier pleinement l'unicité du graphite, il est utile de le comparer au diamant, une autre forme de carbone pur.
La liaison sp³ dans le diamant
Dans le diamant, chaque atome de carbone utilise les quatre de ses électrons externes pour former des liaisons covalentes fortes avec quatre atomes voisins dans un réseau rigide et tridimensionnel.
Pas d'électrons libres, pas de conductivité
Parce que chaque électron est enfermé dans une liaison fixe et localisée, il n'y a pas d'électrons mobiles disponibles pour transporter un courant. C'est pourquoi le diamant est l'un des meilleurs isolants électriques connus.
Comment appliquer cela à votre objectif
Les propriétés uniques de conductivité du graphite dictent son utilisation dans diverses applications.
- Si votre objectif principal est de créer une électrode ou un élément chauffant : Tirez parti de l'excellente conductivité du graphite le long de ses plans, en orientant le matériau de manière à ce que le courant circule parallèlement aux feuilles de graphène.
- Si votre objectif principal est l'isolation électrique : Le graphite est le mauvais choix ; un matériau comme le diamant ou une céramique est nécessaire, car ils n'ont pas d'électrons libres.
- Si votre objectif principal est de gérer la chaleur ou l'électricité de manière directionnelle : La nature anisotrope du graphite est un avantage, vous permettant de canaliser l'énergie le long d'un axe tout en isolant le long d'un autre.
En fin de compte, le graphite sert d'exemple parfait de la façon dont la structure atomique d'un matériau dicte directement ses propriétés les plus fondamentales.
Tableau récapitulatif :
| Facteur clé | Rôle dans la conductivité |
|---|---|
| Hybridation sp² | Crée un réseau hexagonal 2D, laissant un électron par atome délocalisé. |
| Électrons délocalisés | Forme une "mer" de porteurs de charge mobiles qui peuvent se déplacer librement au sein d'une feuille de graphène. |
| Structure en couches | Permet une conductivité élevée le long des feuilles mais une faible conductivité entre elles (anisotropie). |
| Comparaison au diamant (sp³) | Le diamant n'a pas d'électrons libres (tous les électrons sont liés), ce qui en fait un isolant. |
Prêt à exploiter les propriétés conductrices uniques du graphite dans votre laboratoire ?
Chez KINTEK, nous sommes spécialisés dans les équipements de laboratoire et les consommables de haute qualité. Que vous ayez besoin de graphite pour des électrodes, des éléments chauffants ou des applications spécialisées, nos matériaux sont conçus pour offrir des performances supérieures et une conductivité directionnelle.
Contactez-nous dès aujourd'hui pour discuter de la manière dont nos solutions peuvent stimuler votre recherche et votre innovation. Laissez nos experts vous aider à sélectionner les matériaux parfaits pour vos besoins spécifiques en laboratoire.
Contactez notre équipe dès maintenant →
Guide Visuel
Produits associés
- Four de graphitisation sous vide vertical à haute température
- Four de graphitation continue sous vide de graphite
- Four de graphitation sous vide à ultra-haute température au graphite
- Four de graphitisation de film de haute conductivité thermique sous vide de graphite
- Four à tube de laboratoire à haute température de 1400℃ avec tube en alumine
Les gens demandent aussi
- Le point de fusion du graphite est-il élevé ou bas ? Découvrez sa résilience thermique extrême
- Quelle est la résistance à la température du graphite ? Exploiter son potentiel à haute température dans votre laboratoire
- À quoi sert un four à graphite ? Atteindre des températures extrêmes jusqu'à 3000°C dans un environnement contrôlé
- Pourquoi le graphite résiste-t-il à la chaleur ? Dévoiler son extrême stabilité thermique pour votre laboratoire
- Le graphite est-il adapté aux hautes températures ? Libérez son plein potentiel dans les atmosphères contrôlées



















