La chaleur requise pour la calcination n'est pas une valeur unique et universelle. C'est une quantité variable qui dépend entièrement du matériau spécifique traité, de la réaction chimique sous-jacente et de l'efficacité de l'équipement utilisé, tel qu'un four ou un calcineur. Le calcul de cette valeur nécessite la compréhension des principes chimiques et des inefficacités du système dans le monde réel.
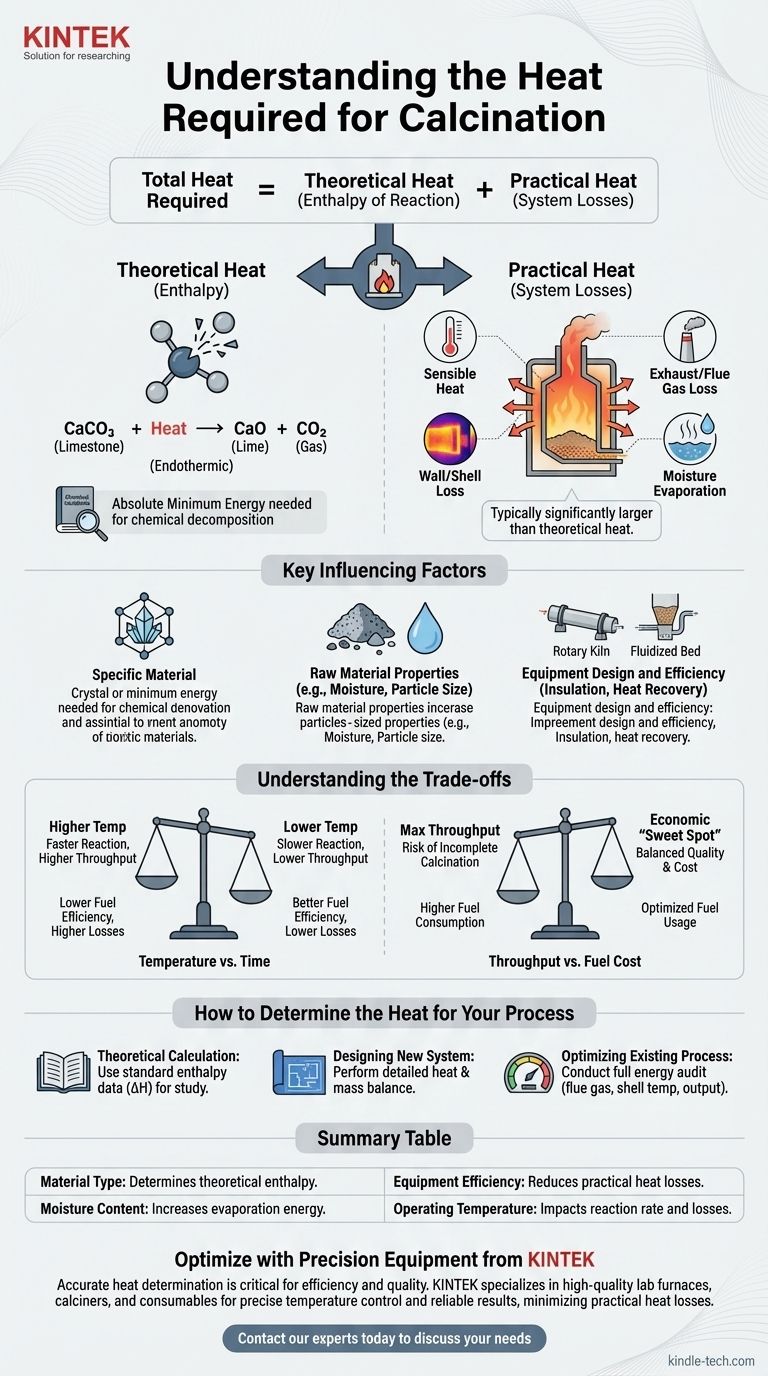
La chaleur totale requise pour tout processus de calcination est la somme de deux composantes distinctes : la chaleur théorique de réaction nécessaire pour rompre les liaisons chimiques du matériau et les pertes de chaleur pratiques inhérentes au système d'exploitation. Une analyse réussie doit tenir compte des deux.

Les deux composantes de la chaleur de calcination
Pour comprendre les exigences énergétiques de la calcination, nous devons séparer le minimum théorique des réalités pratiques des équipements industriels.
Chaleur théorique (Enthalpie de réaction)
C'est la quantité minimale absolue d'énergie requise par les lois de la chimie pour provoquer la réaction de décomposition.
Cette valeur est fixe pour une transformation chimique donnée. Par exemple, la calcination du calcaire (carbonate de calcium, CaCO₃) pour produire de la chaux (oxyde de calcium, CaO) et du dioxyde de carbone (CO₂) est une réaction endothermique, ce qui signifie qu'elle doit absorber une quantité spécifique d'énergie pour se produire.
Cette exigence énergétique théorique peut être calculée ou trouvée dans les manuels de génie chimique pour la plupart des matériaux courants.
Chaleur pratique (Pertes de système)
C'est toute l'énergie supplémentaire qui doit être fournie à un système réel au-delà du minimum théorique. Dans la plupart des opérations industrielles, cette composante est nettement plus importante que la chaleur théorique de réaction.
Les principales sources de pertes de chaleur pratiques comprennent :
- Chaleur sensible : Énergie utilisée pour chauffer le matériau lui-même jusqu'à la température de réaction requise.
- Perte par gaz d'échappement/fumées : Chaleur emportée par les gaz chauds quittant le calcineur.
- Perte par paroi/coque : Chaleur rayonnée et convective s'échappant des surfaces extérieures du four ou du kilns.
- Évaporation de l'humidité : Énergie consommée pour transformer toute eau présente dans la matière première en vapeur avant même que la réaction de calcination ne puisse commencer.
Facteurs clés influençant les besoins en chaleur
Le chiffre final de consommation d'énergie est le résultat de plusieurs variables interdépendantes. Comprendre ces facteurs est crucial pour la conception et l'optimisation des processus.
Le matériau spécifique
Différents matériaux ont des liaisons chimiques et des températures de décomposition très différentes. L'énergie nécessaire pour éliminer l'eau du gypse est bien inférieure à l'énergie nécessaire pour décomposer le carbonate de calcium.
Propriétés de la matière première
L'état physique du matériau est important. Les poudres fines chauffent plus uniformément que les grosses roches, et une teneur en humidité initiale élevée peut augmenter considérablement la consommation d'énergie en raison de la chaleur de vaporisation élevée de l'eau.
Conception et efficacité de l'équipement
Le type d'équipement utilisé, tel qu'un four rotatif, un four à axe ou un calcineur à lit fluidisé, a un impact énorme sur le transfert de chaleur.
Des facteurs tels que la qualité de l'isolation, l'efficacité des joints d'air et la présence de systèmes de récupération de chaleur (comme les préchauffeurs qui utilisent les gaz d'échappement chauds pour préchauffer le matériau entrant) sont les principaux moteurs de l'efficacité thermique globale.
Comprendre les compromis
L'optimisation d'un processus de calcination implique d'équilibrer des objectifs opérationnels concurrents. Ignorer ces compromis conduit souvent à une inefficacité ou à une mauvaise qualité du produit.
Température contre Temps
Des températures de fonctionnement plus élevées peuvent accélérer la réaction de calcination, augmentant le débit. Cependant, cela entraîne souvent des pertes de chaleur plus importantes par la coque de l'équipement et les gaz de combustion, réduisant l'efficacité du carburant.
Inversement, des températures plus basses économisent de l'énergie mais nécessitent que le matériau passe plus de temps dans le calcineur, ce qui peut limiter le taux de production.
Débit contre Coût du carburant
Pousser pour un rendement de production maximal peut entraîner une calcination incomplète ou nécessiter d'injecter tellement de carburant dans le système que l'efficacité globale chute.
Trouver le « juste milieu » économique nécessite d'équilibrer soigneusement la valeur du produit final par rapport au coût du carburant consommé par tonne.
Comment déterminer la chaleur pour votre processus
Il n'existe pas de formule unique, mais vous pouvez déterminer les besoins en chaleur en vous concentrant sur votre objectif spécifique.
- Si votre objectif principal est un calcul théorique pour l'étude : Trouvez l'enthalpie de réaction standard (ΔH) pour votre décomposition chimique spécifique dans une référence de données thermodynamiques.
- Si votre objectif principal est la conception d'un nouveau système : Vous devez effectuer un bilan thermique et matière détaillé qui tienne compte des propriétés du matériau, des spécifications de l'équipement et de toutes les pertes de chaleur potentielles.
- Si votre objectif principal est l'optimisation d'un processus existant : Effectuez un audit énergétique complet de votre équipement, en mesurant les températures des gaz de combustion, le rendement du produit et les températures de la coque pour identifier et quantifier les principales sources de perte de chaleur.
En fin de compte, déterminer avec précision la chaleur de calcination va au-delà d'un simple chiffre pour aboutir à une analyse complète de votre matériau et de votre système spécifiques.
Tableau récapitulatif :
| Facteur | Impact sur les besoins en chaleur |
|---|---|
| Type de matériau | Détermine l'enthalpie de réaction théorique (ex. : calcaire contre gypse). |
| Teneur en humidité | Une humidité élevée augmente considérablement l'énergie nécessaire à l'évaporation. |
| Efficacité de l'équipement | Une meilleure isolation et des systèmes de récupération de chaleur réduisent les pertes de chaleur pratiques. |
| Température de fonctionnement | Des températures plus élevées peuvent augmenter le taux de réaction mais aussi les pertes de chaleur. |
Optimisez votre processus de calcination avec des équipements de précision de KINTEK.
Déterminer avec précision les besoins en chaleur est essentiel pour l'efficacité et la qualité du produit. Que vous conceviez un nouveau système ou optimisiez un système existant, le bon équipement de laboratoire est essentiel pour une analyse thermique et des tests de matériaux précis.
KINTEK est spécialisée dans les fours de laboratoire, les calcineurs et les consommables de haute qualité qui offrent le contrôle précis de la température et la fiabilité nécessaires à votre recherche et au développement de processus. Nos solutions vous aident à minimiser les pertes de chaleur pratiques et à obtenir des résultats optimaux.
Contactez nos experts dès aujourd'hui pour discuter de vos besoins spécifiques en matière de calcination et découvrir comment KINTEK peut améliorer les capacités de votre laboratoire.
Guide Visuel
Produits associés
- Four à moufle de 1800℃ pour laboratoire
- Four à moufle de 1700℃ pour laboratoire
- Four à moufle de laboratoire à moufle à levage par le bas
- Four à moufle de four à étuve de 1400℃ pour laboratoire
- Four à tube de laboratoire à haute température de 1400℃ avec tube en alumine
Les gens demandent aussi
- Qu'est-ce que le biochar dans la réaction de pyrolyse ? Dévoiler son rôle dans l'amélioration des sols et la séquestration du carbone
- Quel est le taux de pyrolyse rapide ? Maximiser le rendement en bio-huile avec un choc thermique contrôlé
- Comment la gazéification est-elle plus avantageuse que la pyrolyse ? Maximiser l'énergie par rapport à la flexibilité des produits
- Qu'est-ce que le processus de pyrolyse éclair ? Maximiser le rendement en bio-huile liquide à partir de la biomasse et du plastique
- Quels sont les effets négatifs de la pyrolyse ? Coûts élevés et risques environnementaux expliqués
- Quelle est la température et le temps de séjour pour la pyrolyse ? Maîtriser les paramètres pour le biochar, le bio-huile ou le syngaz
- Qu'est-ce que la pyrolyse en lit fluidisé ? Convertir efficacement les déchets en bio-huile et en carburants
- Pourquoi la pyrolyse est-elle respectueuse de l'environnement ? Transformer les déchets en énergie propre et en séquestration de carbone



















