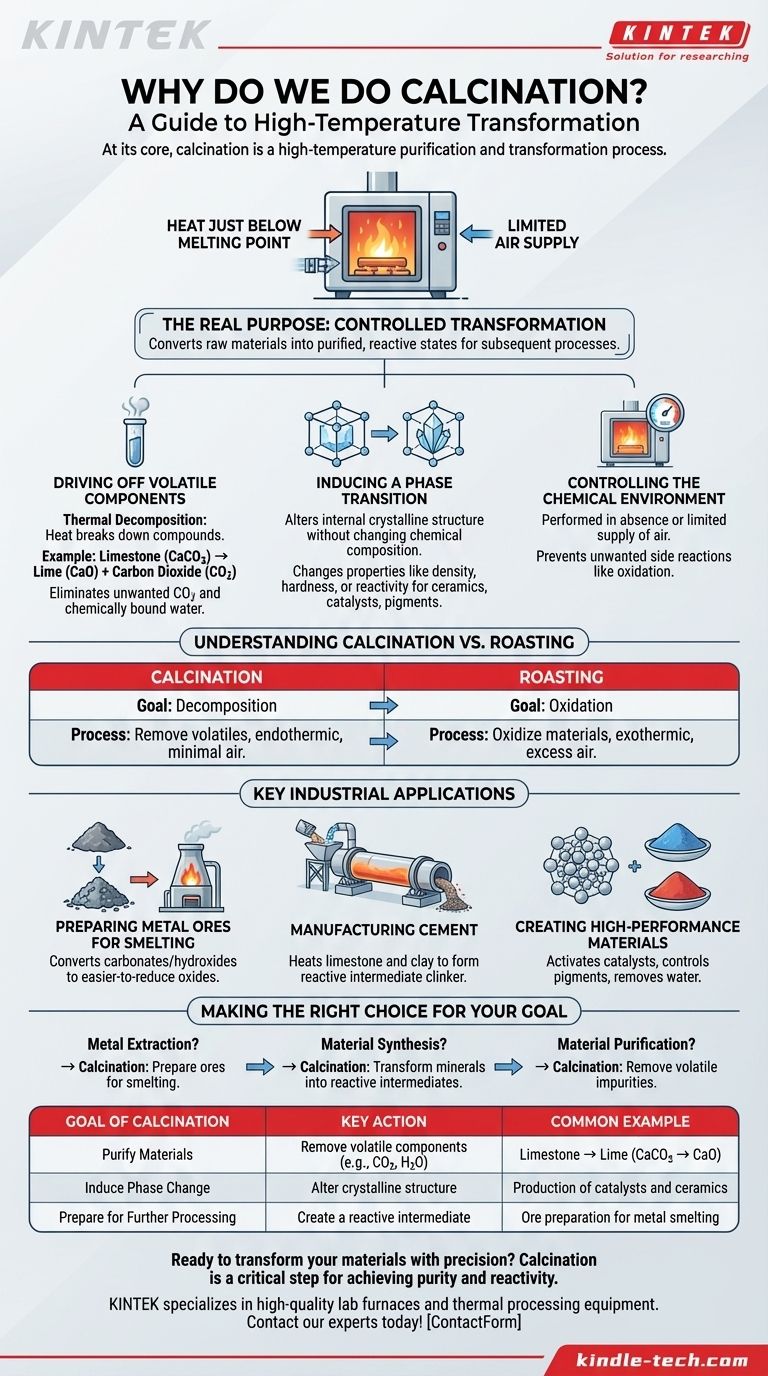
À la base, la calcination est un processus de purification et de transformation à haute température. Elle implique le chauffage d'un matériau solide à une température juste en dessous de son point de fusion, généralement avec un apport d'air limité. Cette chaleur intense est utilisée pour chasser les substances volatiles, provoquer une décomposition thermique ou déclencher un changement dans la structure physique du matériau, le préparant ainsi à son utilisation ultérieure.
Le véritable objectif de la calcination n'est pas seulement le chauffage, mais une transformation contrôlée. C'est l'étape critique qui convertit des matériaux bruts, souvent inertes, comme les minerais, en un état purifié et plus chimiquement réactif, rendant possibles et efficaces les processus ultérieurs comme l'extraction des métaux ou la production de ciment.

Les mécanismes fondamentaux de la calcination
Pour comprendre pourquoi la calcination est si fondamentale en science des matériaux et dans l'industrie, vous devez d'abord comprendre les changements qu'elle induit. Le processus ne consiste pas seulement à sécher une substance ; il s'agit de provoquer un changement chimique ou physique fondamental.
Élimination des composants volatils
Le but le plus courant de la calcination est la décomposition thermique. Il s'agit d'une réaction chimique où la chaleur décompose un composé en deux ou plusieurs substances plus simples.
Un exemple classique est la production de chaux à partir de calcaire. Le calcaire (carbonate de calcium, CaCO3) est chauffé, ce qui le décompose en chaux (oxyde de calcium, CaO) et libère du dioxyde de carbone (CO2) gazeux.
Ce processus élimine le CO2 volatil, indésirable dans le produit final, et laisse derrière lui la chaux utile et réactive. Le même principe s'applique à l'élimination de l'eau chimiquement liée (hydrates) des minéraux.
Induction d'une transition de phase
Parfois, l'objectif n'est pas de modifier la composition chimique, mais d'altérer la structure cristalline interne du matériau. C'est ce qu'on appelle une transition de phase.
Le chauffage peut réorganiser les atomes dans un solide, modifiant ses propriétés comme la densité, la dureté ou la réactivité sans en retirer aucune partie. C'est une étape cruciale dans la production de certaines céramiques, catalyseurs ou pigments où une structure cristalline spécifique est requise pour la performance.
Contrôle de l'environnement chimique
La calcination est presque toujours effectuée en absence ou en apport limité d'air. C'est une distinction critique. L'objectif est de décomposer le matériau par la chaleur, et non de le brûler ou de l'oxyder.
En contrôlant l'atmosphère à l'intérieur du four – qu'elle soit inerte, réductrice ou qu'elle contienne très peu d'oxygène – les ingénieurs peuvent prévenir les réactions secondaires indésirables et assurer que la transformation souhaitée se produit proprement.
Comprendre la distinction clé : Calcination vs. Grillage
Le terme "grillage" est souvent utilisé en parallèle avec la calcination, mais ce sont des processus fondamentalement différents avec des objectifs opposés. Confondre l'un avec l'autre mène à l'échec du processus.
L'objectif de la calcination : la décomposition
Comme discuté, la calcination vise à décomposer un matériau, souvent en éliminant un composant volatil comme le CO2 ou le H2O. C'est typiquement un processus endothermique (il nécessite un apport d'énergie) et est mené avec un minimum d'air pour prévenir l'oxydation.
L'objectif du grillage : l'oxydation
Le grillage, en revanche, est effectué avec un excès d'air ou d'oxygène. Son but spécifique est d'oxyder le matériau. C'est courant en métallurgie pour convertir les minerais de sulfure métallique en oxydes métalliques, qui sont plus faciles à réduire en métal pur par la suite. Le processus est souvent exothermique (il libère de la chaleur).
Applications industrielles clés
La calcination n'est pas une technique de laboratoire obscure ; elle est la pierre angulaire de plusieurs industries mondiales massives.
Préparation des minerais métalliques pour la fusion
En métallurgie, de nombreux métaux se trouvent dans la nature sous forme de carbonates ou d'hydroxydes. La calcination est la première étape essentielle pour convertir ces minerais en leurs formes oxydes. Ces oxydes sont beaucoup plus facilement réduits (l'oxygène est éliminé) dans un four de fusion pour produire le métal pur.
Fabrication du ciment
La production de ciment Portland est l'une des applications à plus grande échelle de la calcination. Les matières premières, principalement le calcaire et l'argile, sont chauffées dans un énorme four rotatif.
La chaleur intense calcine le calcaire en chaux et lui permet de réagir avec les autres minéraux pour former une nouvelle substance appelée clinker. Ce clinker est l'intermédiaire réactif qui, une fois broyé en poudre, devient du ciment.
Création de matériaux haute performance
La calcination est également utilisée à plus petite échelle pour produire des matériaux spécialisés. Elle peut être utilisée pour activer des catalyseurs, contrôler la couleur finale et les propriétés des pigments, ou éliminer l'eau de matériaux comme le gypse pour créer le plâtre de Paris.
Faire le bon choix pour votre objectif
L'application de la calcination est toujours liée à un objectif de transformation spécifique.
- Si votre objectif principal est l'extraction de métaux : La calcination est l'étape préparatoire essentielle pour convertir les minerais de carbonate ou d'hydroxyde en oxydes, qui sont beaucoup plus faciles à réduire en métal pur.
- Si votre objectif principal est la synthèse de matériaux (comme le ciment) : La calcination est le moteur chimique essentiel qui transforme les minéraux bruts et inactifs en un intermédiaire hautement réactif comme le clinker.
- Si votre objectif principal est la purification des matériaux : La calcination sert à éliminer les impuretés volatiles, telles que l'eau liée ou les composés à base de carbone, pour créer un produit final stable et pur.
En fin de compte, la calcination est le processus thermique fondamental pour convertir les matières premières en produits précieux et fonctionnels.
Tableau récapitulatif :
| Objectif de la calcination | Action clé | Exemple courant |
|---|---|---|
| Purifier les matériaux | Éliminer les composants volatils (ex. CO2, H2O) | Calcaire → Chaux (CaCO3 → CaO) |
| Induire un changement de phase | Modifier la structure cristalline | Production de catalyseurs et de céramiques |
| Préparer pour un traitement ultérieur | Créer un intermédiaire réactif | Préparation du minerai pour la fusion des métaux |
Prêt à transformer vos matériaux avec précision ? La calcination est une étape critique pour atteindre la pureté et la réactivité de vos produits. KINTEK est spécialisé dans les fours de laboratoire de haute qualité et les équipements de traitement thermique conçus pour des processus de calcination fiables. Que vous soyez dans la métallurgie, la production de ciment ou la synthèse de matériaux avancés, nos solutions garantissent des résultats contrôlés et efficaces. Contactez nos experts dès aujourd'hui pour discuter de la manière dont nous pouvons répondre à vos besoins spécifiques en matière de traitement thermique !
Guide Visuel
Produits associés
- Fourneuse de pyrolyse de four rotatif électrique Machine calcineuse Petit four rotatif Four rotatif
- Four rotatif continu scellé sous vide Four rotatif
- Petite usine de pyrolyse continue à four rotatif électrique pour le chauffage
- Four rotatif à tubes multiples zones chauffantes divisées
- Four de régénération électrique pour charbon actif à four rotatif
Les gens demandent aussi
- Quelle biomasse est utilisée en pyrolyse ? Sélectionner la matière première optimale pour vos objectifs
- Quel est le but d'un calcinateur ? Améliorer l'efficacité du traitement à haute température
- Quels sont les produits de la pyrolyse du bois ? Un guide sur les rendements en biochar, bio-huile et gaz de synthèse
- Quelles sont les zones d'un four rotatif dans la production de ciment ? Maîtrisez le processus de base pour un clinker de haute qualité
- Quelle est la différence entre la calcination et la torréfaction ? Un guide sur le traitement à haute température



















