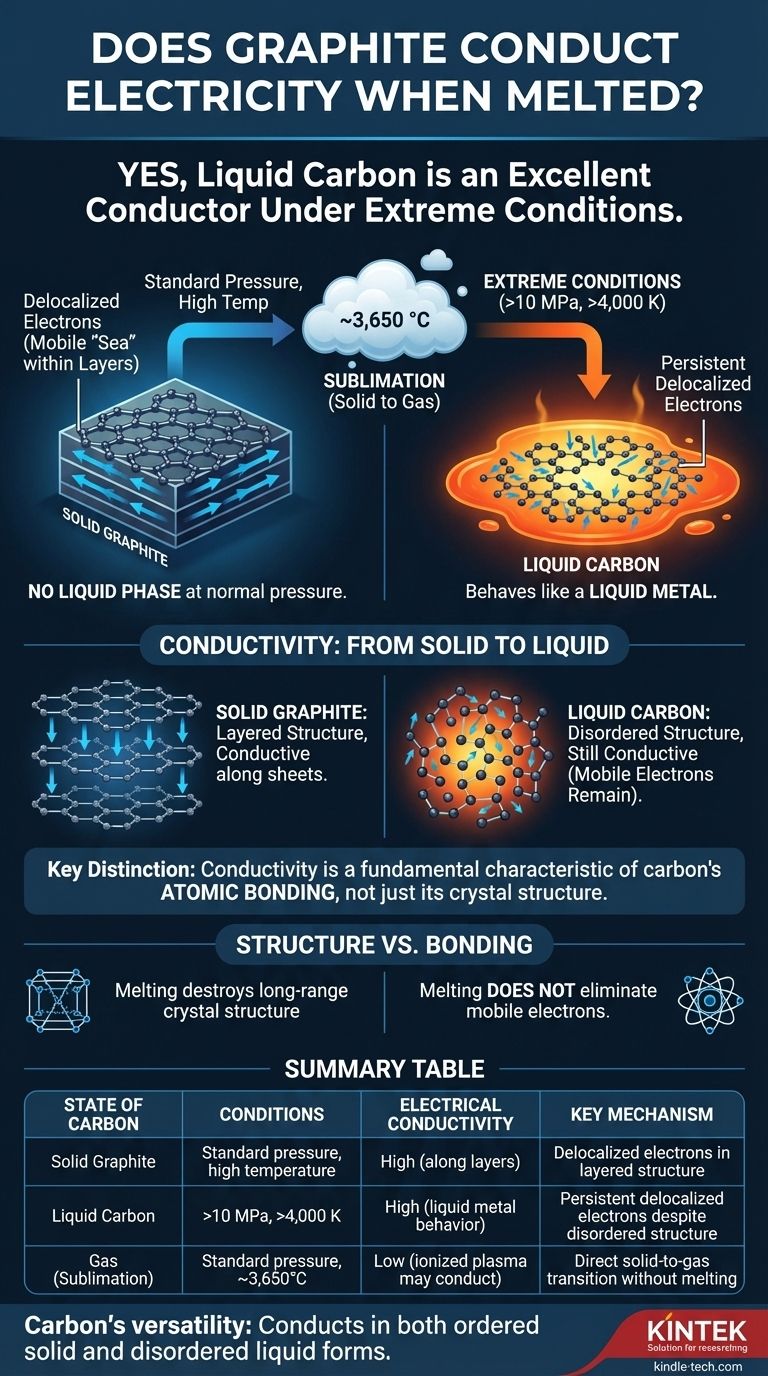
Oui, dans les conditions extrêmes requises pour le faire fondre, le carbone liquide est un excellent conducteur électrique. Bien que le graphite ne fonde pas à pression atmosphérique normale, le carbone liquide qui peut être formé à très hautes pressions et températures se comporte comme un métal liquide, avec des électrons libres de se déplacer et de transporter un courant électrique.
La question n'est pas simplement de savoir si le graphite en fusion conduit l'électricité — il le fait — mais pourquoi. La réponse révèle que la conductivité n'est pas uniquement une propriété de la célèbre structure en couches du graphite, mais une caractéristique plus fondamentale de la liaison atomique du carbone qui persiste même dans un état liquide désordonné.

Le Défi de la Fusion du Graphite
Pour comprendre la conduction dans le carbone liquide, nous devons d'abord apprécier à quel point il est difficile de le créer. À des fins pratiques, le graphite n'a pas de phase liquide.
Sublimation, Pas Fusion
À pression atmosphérique standard, lorsque vous chauffez le graphite à sa limite, il ne devient pas liquide. Au lieu de cela, il se sublime — passant directement de l'état solide à l'état gazeux à des températures avoisinant 3 650 °C (6 600 °F).
La Nécessité de Conditions Extrêmes
Pour forcer le carbone à l'état liquide, vous devez appliquer simultanément une pression et une température immenses. Le carbone liquide n'existe qu'à des pressions supérieures à 10 mégapascals (~100 fois la pression atmosphérique normale) et à des températures dépassant 4 000 K (~3 727 °C ou 6 740 °F).
Conductivité : Du Solide au Liquide
La raison pour laquelle le graphite solide et le carbone liquide conduisent l'électricité réside dans la nature unique des électrons du carbone.
Comment le Graphite Solide Conduit
Dans le graphite solide, les atomes de carbone sont disposés en feuilles hexagonales plates. Chaque atome de carbone forme des liaisons fortes avec trois voisins, laissant son quatrième électron externe délocalisé.
Ces électrons délocalisés ne sont liés à aucun atome unique. Au lieu de cela, ils forment une « mer » mobile d'électrons au sein de chaque feuille, ce qui explique pourquoi le graphite est un excellent conducteur électrique le long de ses couches.
Conduction à l'État Liquide
Lorsque le graphite est forcé de fondre, sa structure rigide et stratifiée est détruite. Les atomes deviennent désordonnés et peuvent se déplacer librement, comme dans n'importe quel liquide.
Cependant, l'environnement de liaison local permet toujours la présence d'électrons délocalisés. Le liquide est un mélange complexe et fluctuant de types de liaisons, mais la présence d'électrons mobiles persiste. Cela fait que le carbone liquide se comporte comme un métal liquide, avec une conductivité électrique élevée.
Comprendre la Distinction Clé
Il est facile de supposer que la conductivité du graphite est uniquement le résultat de sa structure en forme de feuille. Le comportement du carbone liquide prouve que c'est une image incomplète.
Structure Contre Liaison
Le point essentiel à retenir est la différence entre la structure et la liaison. Bien que la fusion détruise la structure cristalline à longue portée du graphite, elle n'élimine pas la liaison atomique fondamentale qui permet aux électrons de devenir mobiles.
Une Limitation Pratique
Ce phénomène est principalement d'intérêt en physique extrême et en science des matériaux. Dans la plupart des applications d'ingénierie, comme dans les fours à arc électrique, vous avez affaire à un électrode de graphite solide qui se sublime en un gaz chaud et ionisé (un plasma), et non à une piscine de carbone liquide.
Donner un Sens aux Propriétés du Carbone
Votre compréhension de ce sujet dépend de votre objectif. Utilisez ces points pour cadrer le concept pour votre contexte spécifique.
- Si votre objectif principal est la chimie fondamentale : La conductivité du carbone liquide démontre que les électrons délocalisés, une caractéristique de la liaison sp2 du carbone, ne sont pas perdus lorsque la structure réticulaire rigide fond.
- Si votre objectif principal est l'ingénierie pratique : Pour pratiquement toutes les applications, rappelez-vous que le graphite se sublimera en gaz bien avant d'avoir la possibilité de fondre, un facteur critique pour la conception de systèmes à haute température.
En fin de compte, la capacité du carbone à conduire l'électricité sous sa forme solide ordonnée et sous sa forme liquide désordonnée révèle la remarquable polyvalence de ses liaisons atomiques.
Tableau Récapitulatif :
| État du Carbone | Conditions Requises | Conductivité Électrique | Mécanisme Clé |
|---|---|---|---|
| Graphite Solide | Pression standard, haute température | Élevée (le long des couches) | Électrons délocalisés dans une structure en couches |
| Carbone Liquide | >10 MPa, >4 000 K | Élevée (comportement de métal liquide) | Électrons délocalisés persistants malgré une structure désordonnée |
| Gaz (Sublimation) | Pression standard, ~3 650°C | Faible (le plasma ionisé peut conduire) | Transition directe solide-gaz sans fusion |
Débloquez la Précision dans la Recherche à Haute Température avec KINTEK
Comprendre les comportements des matériaux extrêmes, comme la conductivité du carbone liquide, nécessite un équipement de laboratoire fiable. KINTEK se spécialise dans les fours de laboratoire haute performance, les électrodes et les consommables conçus pour des conditions rigoureuses. Que vous exploriez la science des matériaux ou développiez des systèmes d'ingénierie avancés, nos produits garantissent précision et durabilité.
Prêt à améliorer les capacités de votre laboratoire ? Contactez-nous dès aujourd'hui pour discuter de la manière dont les solutions de KINTEK peuvent soutenir vos expériences et objectifs de recherche à haute température.
Guide Visuel
Produits associés
- Four de graphitisation sous vide vertical à haute température
- Four de graphitation continue sous vide de graphite
- Four de graphitation sous vide à ultra-haute température au graphite
- Four de graphitisation de film de haute conductivité thermique sous vide de graphite
- Four à tube de laboratoire à haute température de 1400℃ avec tube en alumine
Les gens demandent aussi
- Quel est le principe de base de la spectroscopie d'absorption atomique à four en graphite ? Atteindre la détection d'éléments ultra-traces
- Quelle est la différence entre le four en graphite et l'AAS à flamme ? Choisissez la bonne technique pour votre laboratoire
- Comment le graphite synthétique est-il fabriqué ? Une plongée profonde dans le processus à haute température
- Qu'est-ce que la technique du four à graphite ? Atteignez des températures extrêmes pour les matériaux avancés
- Comment fonctionne un four à graphite ? Atteindre des températures extrêmes dans un environnement pur
- Quelles sont les interférences du four à graphite ? Surmonter les problèmes de matrice et de spectre pour une GFAAS précise
- Pourquoi le four au graphite est-il plus sensible que la flamme ? Déverrouiller la détection ultra-trace pour votre laboratoire
- Pourquoi un four en graphite est-il plus sensible qu'une flamme ? Débloquer une analyse de traces supérieure



















