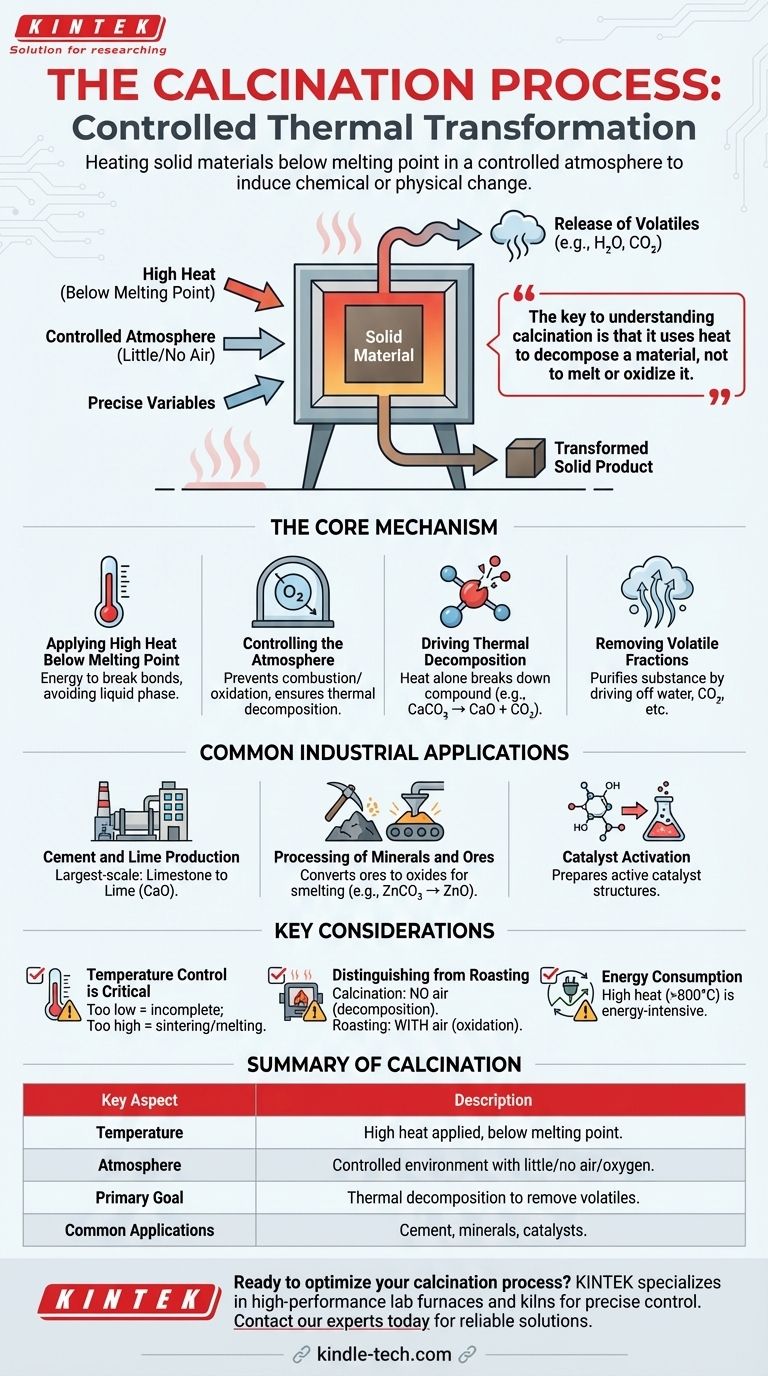
À la base, la calcination est un processus de traitement thermique effectué en chauffant un matériau solide à une température élevée, mais inférieure à son point de fusion, dans un environnement avec peu ou pas d'air. Ce chauffage contrôlé n'est pas destiné à brûler le matériau, mais plutôt à induire un changement chimique ou physique, tel que l'élimination de substances volatiles comme l'eau et le dioxyde de carbone ou la modification de sa structure cristalline.
La clé pour comprendre la calcination est qu'elle utilise la chaleur pour décomposer un matériau, non pour le faire fondre ou l'oxyder. L'atmosphère contrôlée — spécifiquement l'absence d'air — est ce qui la distingue des autres processus basés sur la chaleur et permet des transformations chimiques ciblées.

Le mécanisme fondamental de la calcination
La calcination est un processus industriel précis et largement utilisé. Son efficacité repose sur le contrôle minutieux de deux facteurs principaux : la température et l'atmosphère.
Application d'une chaleur élevée en dessous du point de fusion
Le matériau est placé à l'intérieur d'un four spécialisé, tel qu'un four rotatif ou un four à cuve. La température est considérablement augmentée pour fournir l'énergie nécessaire à la rupture des liaisons chimiques.
Crucialement, cette température reste inférieure au point de fusion du matériau. L'objectif est une transformation à l'état solide, et non un changement en phase liquide.
Contrôle de l'atmosphère
La calcination se définit par son exécution en l'absence ou avec un apport très limité d'air (oxygène). Ceci est essentiel car cela empêche la combustion ou l'oxydation.
Au lieu de brûler, le matériau subit une décomposition thermique. Cette atmosphère contrôlée garantit que la chaleur est le seul agent de changement.
Déclenchement de la décomposition thermique
La chaleur agit seule comme catalyseur pour décomposer le composé en substances plus simples. L'exemple le plus courant est la décomposition des carbonates.
Lorsque le calcaire (carbonate de calcium, CaCO₃) est calciné, la chaleur le décompose en chaux (oxyde de calcium, CaO) et en dioxyde de carbone (CO₂), qui est libéré sous forme de gaz.
Élimination des fractions volatiles
Le but principal de la calcination est souvent de "purifier" une substance en éliminant un composant volatil. Il peut s'agir d'eau provenant de minéraux hydratés, de dioxyde de carbone provenant de carbonates, ou d'autres composés organiques volatils.
Le résultat est un produit solide plus concentré et souvent plus réactif. Par exemple, la calcination du minerai de bauxite élimine l'eau, le préparant pour la production d'aluminium.
Applications industrielles courantes
La calcination n'est pas une technique de laboratoire obscure ; c'est un processus fondamental dans plusieurs grandes industries mondiales.
Production de ciment et de chaux
C'est l'application de calcination à la plus grande échelle. Des millions de tonnes de calcaire sont calcinées annuellement pour produire de la chaux, un ingrédient fondamental dans le ciment, le mortier et le plâtre.
Traitement des minéraux et des minerais
La calcination est une étape clé en métallurgie. Elle est utilisée pour convertir les minerais métalliques en leurs formes oxydes, qui sont plus faciles à réduire en métal pur lors d'un processus de fusion ultérieur. Par exemple, le carbonate de zinc (ZnCO₃) est calciné pour produire de l'oxyde de zinc (ZnO).
Activation de catalyseurs
Dans l'industrie chimique, de nombreux catalyseurs sont préparés comme matériaux précurseurs. La calcination est utilisée pour chauffer ces précurseurs, éliminant les composants indésirables et créant la structure catalytique finale, hautement poreuse et active.
Comprendre les considérations clés
Bien que le principe soit simple, une calcination industrielle réussie nécessite une gestion minutieuse de plusieurs variables.
Le contrôle de la température est essentiel
Si la température est trop basse, la réaction de décomposition sera incomplète, ce qui entraînera un produit de mauvaise qualité. Si la température est trop élevée, le matériau peut se fritter (fusionner en une masse solide) ou fondre, réduisant sa réactivité et sa surface spécifique.
Distinction avec le grillage
La calcination est souvent confondue avec le grillage, un autre processus thermique. La différence clé est l'atmosphère : la calcination se produit sans air, tandis que le grillage est effectué avec un excès d'air spécifiquement pour favoriser l'oxydation.
Consommation d'énergie
Le chauffage des matériaux aux températures élevées requises pour la calcination (souvent >800°C ou 1500°F) est extrêmement énergivore. Cela fait de l'efficacité énergétique une préoccupation majeure dans la conception et le fonctionnement des fours.
Adapter le processus à votre objectif
Les paramètres spécifiques de la calcination sont toujours adaptés au matériau de départ et au résultat souhaité.
- Si votre objectif principal est la production de ciment ou de chaux : Vous effectuerez une calcination sur le calcaire (CaCO₃) pour le décomposer thermiquement en chaux (CaO) en éliminant le CO₂.
- Si votre objectif principal est la préparation d'un minerai métallique pour la fusion : Vous utiliserez la calcination pour convertir un minerai de carbonate ou d'hydrate en sa forme oxyde, ce qui le rendra plus facile à traiter par la suite.
- Si votre objectif principal est la création d'un matériau de haute pureté : Vous utiliserez la calcination pour éliminer les impuretés volatiles comme l'eau, laissant derrière un solide plus concentré et souvent plus réactif.
En fin de compte, la calcination est un outil thermique précis utilisé pour transformer chimiquement des matériaux solides en appliquant soigneusement de la chaleur dans une atmosphère contrôlée.
Tableau récapitulatif :
| Aspect clé | Description |
|---|---|
| Température | Chaleur élevée appliquée, mais inférieure au point de fusion du matériau. |
| Atmosphère | Environnement contrôlé avec peu ou pas d'air/oxygène. |
| Objectif principal | Décomposition thermique pour éliminer les substances volatiles (par exemple, eau, CO₂). |
| Applications courantes | Production de ciment, traitement des minéraux, activation de catalyseurs. |
Prêt à optimiser votre processus de calcination ? KINTEK est spécialisé dans les fours de laboratoire et les fours industriels haute performance qui offrent le contrôle précis de la température et la gestion de l'atmosphère nécessaires pour une décomposition thermique efficace. Que vous soyez dans la recherche, la métallurgie ou la production chimique, notre équipement garantit des résultats fiables. Contactez nos experts dès aujourd'hui pour trouver la solution de calcination parfaite pour vos besoins de laboratoire !
Guide Visuel
Produits associés
- Fourneuse de pyrolyse de four rotatif électrique Machine calcineuse Petit four rotatif Four rotatif
- Petite usine de pyrolyse continue à four rotatif électrique pour le chauffage
- Four rotatif à tubes multiples zones chauffantes divisées
- Four rotatif continu scellé sous vide Four rotatif
- Four de régénération électrique pour charbon actif à four rotatif
Les gens demandent aussi
- Quel est le principe du four rotatif ? Maîtriser le traitement thermique continu
- Quelles sont les applications industrielles de la pyrolyse ? Transformer les déchets en énergie et en produits de valeur
- Quels sont les types de réacteurs de pyrolyse utilisés dans l'industrie ? Choisissez la bonne technologie pour votre produit
- Quels sont les produits de la pyrolyse du bois ? Un guide sur les rendements en biochar, bio-huile et gaz de synthèse
- Quelles sont les zones d'un four rotatif dans la production de ciment ? Maîtrisez le processus de base pour un clinker de haute qualité



















