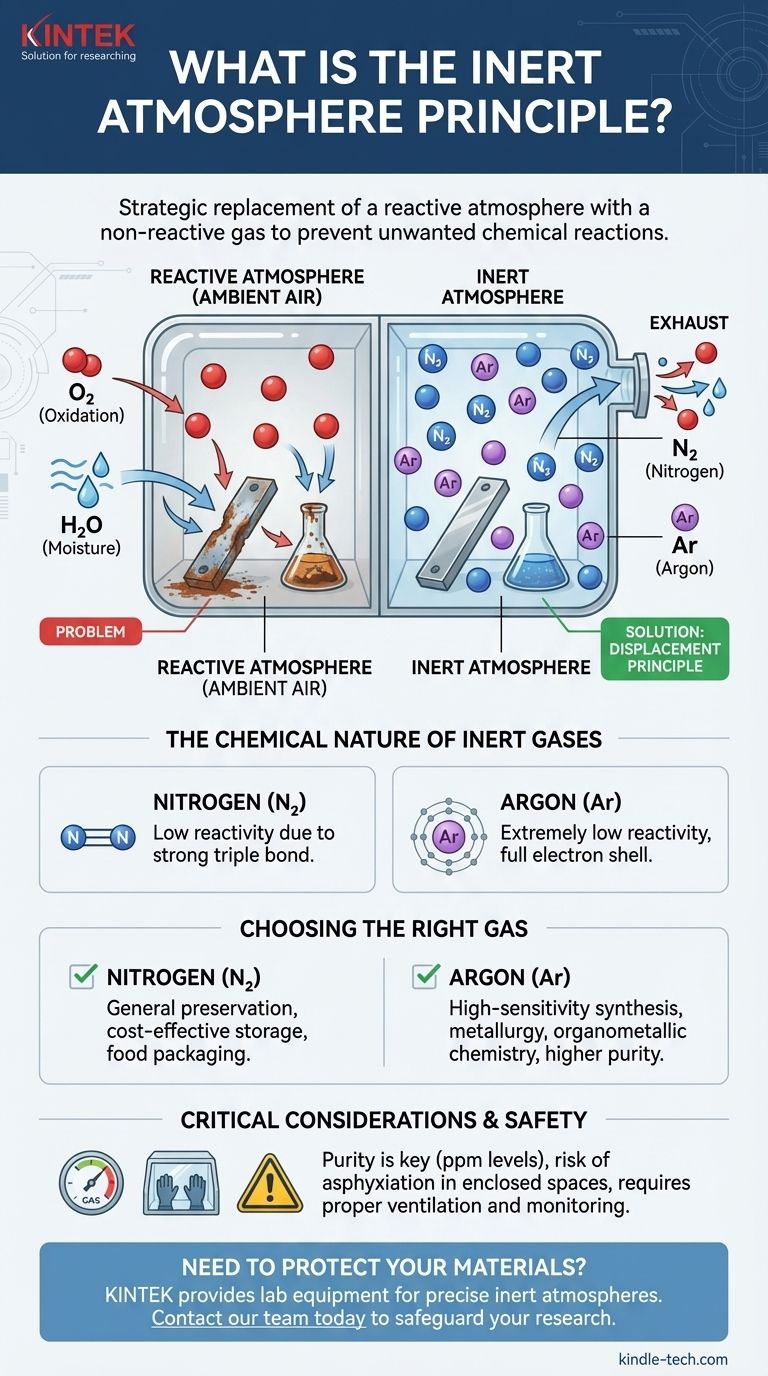
Le principe de l'atmosphère inerte consiste à remplacer stratégiquement une atmosphère réactive, comme l'air ambiant, par un gaz non réactif (inerte). Ceci est fait pour créer un environnement contrôlé qui empêche les réactions chimiques indésirables, telles que l'oxydation et la dégradation due à l'humidité. Les gaz inertes les plus couramment utilisés à cette fin sont l'azote et l'argon, qui déplacent l'oxygène et la vapeur d'eau d'un système.
L'objectif d'une atmosphère inerte n'est pas d'ajouter un ingrédient spécial, mais de supprimer ceux qui sont problématiques. En déplaçant systématiquement les gaz réactifs comme l'oxygène et l'eau, vous créez un environnement stable qui protège les matériaux sensibles et garantit que les processus chimiques se déroulent sans interférence.

Le problème : la réactivité atmosphérique incontrôlée
L'air normal, l'environnement dans lequel nous existons, est un mélange chimique étonnamment réactif. Pour de nombreux processus scientifiques et industriels, cette réactivité est un problème important.
Pourquoi l'air normal est un défi
Notre atmosphère est composée d'environ 21 % d'oxygène et de quantités variables de vapeur d'eau. Ces deux composants sont très réactifs et avides de participer à des réactions chimiques.
L'oxygène est un puissant agent oxydant, ce qui signifie qu'il accepte facilement les électrons d'autres substances. C'est la cause profonde de processus courants comme la rouille et la combustion.
L'impact de l'oxydation et de la dégradation
Lorsque des matériaux sensibles sont exposés à l'air, ils peuvent se dégrader rapidement. Par exemple, l'oxygène peut ruiner une expérience électrochimique délicate en réagissant à la surface de l'électrode, masquant les résultats que vous essayez de mesurer.
De même, de nombreux produits chimiques avancés, produits pharmaceutiques et réactifs se décomposeront ou perdront leur puissance lorsqu'ils seront exposés à l'oxygène ou à l'humidité. Ce principe explique également pourquoi les fabricants de produits alimentaires emballent des produits comme les croustilles dans des sacs remplis d'azote pour empêcher les huiles de rancir.
Comment une atmosphère inerte résout le problème
Une atmosphère inerte contrecarre directement la menace de la réactivité atmosphérique en modifiant physiquement l'environnement au niveau gazeux.
Le principe du déplacement
La technique de base consiste à purger un récipient, un réacteur ou une chambre avec un gaz inerte. Lorsque le gaz inerte s'écoule, il repousse physiquement, ou déplace, l'air ambiant contenant de l'oxygène et de la vapeur d'eau.
Ceci est souvent réalisé en faisant barboter le gaz inerte (comme l'argon ou l'azote) à travers une solution liquide ou en rinçant continuellement une enceinte scellée, telle qu'une boîte à gants.
La nature chimique des gaz inertes
Des gaz comme l'azote (N₂) et l'argon (Ar) sont choisis parce qu'ils sont extrêmement non réactifs.
L'argon est un gaz noble, ce qui signifie que sa couche électronique la plus externe est pleine. Il n'a aucune incitation chimique à réagir avec d'autres éléments.
L'azote gazeux est une molécule diatomique (N₂) maintenue par une triple liaison exceptionnellement forte. Une quantité importante d'énergie est nécessaire pour briser cette liaison, ce qui rend l'azote gazeux très stable et peu susceptible de participer à la plupart des réactions dans des conditions normales.
Comprendre les compromis
Bien que le principe soit simple, son application pratique implique des choix importants et des défis potentiels.
Choisir le bon gaz : azote ou argon
L'azote est le cheval de bataille des atmosphères inertes. Il est beaucoup moins cher que l'argon et est suffisamment inerte pour la grande majorité des applications, de l'emballage alimentaire au stockage chimique général.
L'argon est utilisé pour les applications très sensibles où la moindre réactivité ne peut être tolérée. Il est chimiquement plus inerte que l'azote et, étant plus dense que l'air, peut former une "couverture" protectrice plus stable sur un processus. Cela le rend idéal pour la métallurgie à haute température et la synthèse organométallique sensible.
Le défi de la pureté
Une simple purge du système une seule fois peut ne pas suffire. Même des traces d'oxygène ou de vapeur d'eau (mesurées en parties par million) peuvent suffire à perturber des expériences très sensibles ou à dégrader des matériaux ultra-purs.
Atteindre et maintenir un niveau élevé de pureté nécessite souvent une purge continue, une étanchéité méticuleuse du système et parfois l'utilisation de purificateurs d'oxygène pour éliminer les dernières traces résiduelles.
Considérations de sécurité critiques
Les gaz inertes sont des asphyxiants simples. Ils ne sont pas toxiques, mais ils déplacent l'oxygène nécessaire à la respiration. Travailler dans un espace clos où un gaz inerte est utilisé peut être extrêmement dangereux et nécessite une ventilation adéquate et une surveillance continue de l'oxygène pour prévenir l'asphyxie.
Faire le bon choix pour votre objectif
Le choix de la bonne approche dépend entièrement de votre objectif, de votre budget et de vos exigences de sensibilité.
- Si votre objectif principal est la conservation générale ou le stockage en vrac : L'azote est presque toujours le choix le plus rentable et le plus pratique pour prévenir l'oxydation.
- Si votre objectif principal est la synthèse ou l'électrochimie de haute sensibilité : L'argon est le choix supérieur pour son absence quasi totale de réactivité, justifiant son coût plus élevé.
- Si votre objectif principal est le traitement des métaux à haute température : L'argon est essentiel, car l'azote peut réagir avec certains métaux à haute température pour former des nitrures indésirables.
En fin de compte, maîtriser le principe de l'atmosphère inerte, c'est contrôler l'environnement chimique pour obtenir des résultats prévisibles et fiables.
Tableau récapitulatif :
| Aspect | Azote (N₂) | Argon (Ar) |
|---|---|---|
| Utilisation principale | Conservation générale, stockage économique | Synthèse de haute sensibilité, processus à haute température |
| Réactivité | Faible (triple liaison forte) | Extrêmement faible (gaz noble) |
| Coût | Inférieur | Supérieur |
| Idéal pour | Emballage alimentaire, stockage de produits chimiques en vrac | Métallurgie, chimie organométallique, électrochimie sensible |
Besoin de protéger vos matériaux ou processus de l'oxydation ?
Chez KINTEK, nous sommes spécialisés dans la fourniture de l'équipement de laboratoire et des consommables adaptés pour créer et maintenir des atmosphères inertes précises pour votre application spécifique. Que vous ayez besoin d'une solution d'azote économique ou d'un environnement d'argon ultra-pur pour des travaux sensibles, nos experts peuvent vous aider à sélectionner le système optimal.
Contactez notre équipe dès aujourd'hui pour discuter de la façon dont nous pouvons protéger votre recherche et votre production avec des solutions d'atmosphère inerte fiables.
Guide Visuel
Produits associés
- Four à atmosphère contrôlée 1200℃ Four à atmosphère inerte d'azote
- Four à atmosphère contrôlée de 1400℃ avec atmosphère d'azote et inerte
- Four à atmosphère contrôlée 1700℃ Four à atmosphère inerte d'azote
- Four à atmosphère d'hydrogène contrôlée à l'azote
- Four à tube de laboratoire à haute température de 1400℃ avec tube en alumine
Les gens demandent aussi
- Pourquoi un four à haute température avec protection au gaz inerte est-il requis pour le vieillissement thermique de l'acier inoxydable ?
- Qu'est-ce qu'une atmosphère réductrice ? Optimisez le traitement des matériaux en prévenant l'oxydation
- Quel est le rôle d'un four à atmosphère à haute température dans la fixation de l'azote ? Master Catalyst Precision Engineering
- Pour quels types de matériaux une atmosphère d'hydrogène pur est-elle efficace pour le frittage à haute température ? Principaux points à retenir
- Pourquoi est-il nécessaire d'utiliser des équipements à atmosphère contrôlée pour les électrolytes solides sulfurés ? Assurer une conductivité élevée
- Quels sont les différents types d'atmosphères préparées à base d'azote ? Choisissez Lean ou Rich pour un traitement thermique optimal
- À quoi sert une atmosphère inerte ? Prévenir l'oxydation et assurer la sécurité des processus
- Qu'est-ce qu'un four à atmosphère contrôlée ? Atteignez la pureté et la précision dans le traitement à haute température



















