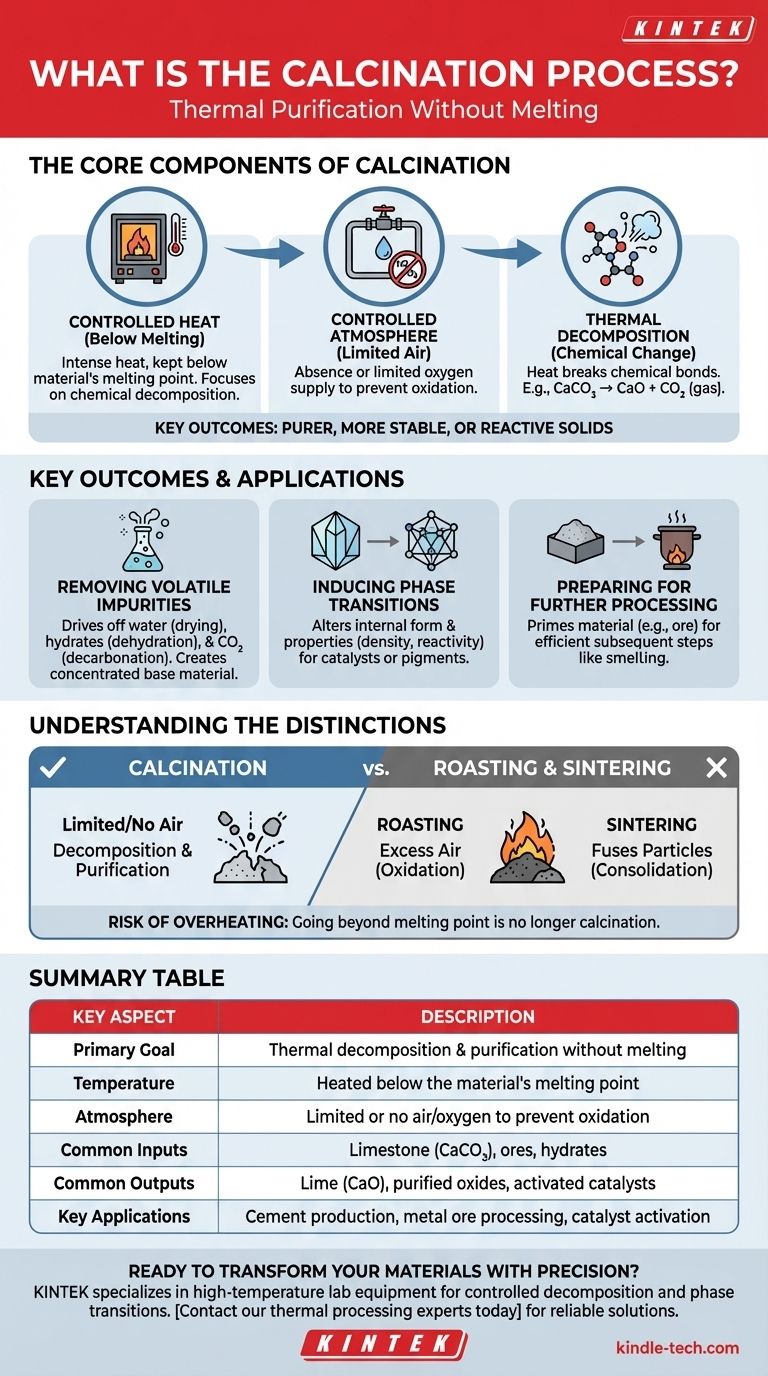
Essentiellement, la calcination est un processus de purification thermique. Elle implique le chauffage d'un matériau solide à une température élevée, mais en dessous de son point de fusion, dans une atmosphère contrôlée avec peu ou pas d'air. Ce chauffage précis permet d'éliminer les substances volatiles comme l'eau et le dioxyde de carbone, de déclencher une décomposition chimique ou de modifier la structure cristalline interne du matériau, ce qui donne un solide plus pur, plus stable ou plus réactif.
Le but principal de la calcination n'est pas de faire fondre un matériau, mais de le transformer. En contrôlant soigneusement la chaleur et l'atmosphère, vous pouvez éliminer sélectivement les composants indésirables ou modifier les propriétés d'un matériau sans altérer son état solide.

Comment fonctionne fondamentalement la calcination
Pour comprendre la calcination, il est essentiel de saisir ses trois composantes principales : la chaleur contrôlée, une atmosphère spécifique et les changements chimiques qui en résultent.
Le rôle de la chaleur (en dessous du point de fusion)
Le paramètre le plus critique de la calcination est la température. Le matériau est chauffé intensément, mais toujours maintenu en dessous de son point de fusion.
Cela garantit que le processus se concentre sur la décomposition chimique plutôt que sur un changement d'état (du solide au liquide). Il permet la décomposition contrôlée des composés au sein de la structure solide.
L'atmosphère contrôlée
La calcination est généralement effectuée en l'absence ou avec un apport limité d'air (oxygène).
C'est une distinction cruciale. En limitant l'oxygène, vous empêchez l'oxydation ou la combustion. L'objectif est de décomposer le matériau par la chaleur seule (décomposition thermique), et non de le faire réagir avec l'oxygène.
L'objectif principal : la décomposition
La chaleur appliquée pendant la calcination fournit l'énergie nécessaire pour rompre les liaisons chimiques. C'est ce qu'on appelle la décomposition thermique.
Un exemple classique est la production de chaux à partir de calcaire. Lorsque le calcaire (carbonate de calcium, CaCO₃) est calciné, il se décompose en chaux (oxyde de calcium, CaO) et libère du dioxyde de carbone (CO₂) gazeux, un composant volatile.
Principaux résultats de la calcination
Selon le matériau et l'objectif, la calcination permet d'obtenir plusieurs résultats spécifiques.
Élimination des impuretés volatiles
L'application la plus courante est la purification. Le processus élimine les substances volatiles, qui sont des composants qui se transforment facilement en gaz lorsqu'ils sont chauffés.
Cela inclut l'eau physiquement liée (séchage), l'eau chimiquement liée dans les hydrates (déshydratation) et le dioxyde de carbone des minerais carbonatés (décarbonatation). Le résultat est une version plus concentrée et purifiée du matériau de base.
Induction de transitions de phase
Parfois, l'objectif n'est pas d'éliminer quoi que ce soit, mais de modifier la forme interne du matériau.
La calcination peut induire une transition de phase, qui modifie la structure cristalline du matériau. Cela peut changer ses propriétés, telles que la dureté, la densité ou la réactivité, le rendant adapté à une application spécifique comme un catalyseur ou un pigment.
Préparation des matériaux pour un traitement ultérieur
Souvent, la calcination est une étape préparatoire. En éliminant les impuretés et en créant une substance plus réactive (comme un oxyde), le matériau est préparé pour un processus ultérieur.
Par exemple, la calcination d'un minerai peut rendre l'extraction ultérieure du métal final par fusion plus efficace et moins énergivore.
Comprendre les compromis et les distinctions
La calcination est souvent confondue avec d'autres processus thermiques. Comprendre les différences est essentiel pour comprendre sa fonction spécifique.
Calcination vs. grillage
Le grillage est un autre processus thermique, mais il est effectué avec un excès d'air. Son objectif est de provoquer intentionnellement l'oxydation. Par exemple, la conversion d'un minerai de sulfure métallique en oxyde métallique. La calcination, en revanche, évite activement l'oxydation.
Calcination vs. frittage
Le frittage utilise également la chaleur en dessous du point de fusion, mais son objectif est entièrement différent. Le frittage vise à fusionner de petites particules pour augmenter la densité et la résistance du matériau. La calcination purifie et décompose ; le frittage consolide. Dans de nombreux flux de travail industriels, la calcination est effectuée en premier, suivie du frittage.
Le risque de surchauffe
Le contrôle de la température est primordial. Si le matériau est chauffé au-delà de son point de fusion, le processus n'est plus de la calcination. Il devient de la fusion ou du frittage, ce qui peut être indésirable et conduire à un produit final complètement différent, et souvent inutilisable.
Faire le bon choix pour votre objectif
La calcination est un outil précis utilisé pour réaliser des transformations spécifiques de matériaux. Votre objectif dicte son application.
- Si votre objectif principal est de purifier un minerai : Utilisez la calcination pour éliminer l'eau et les carbonates, créant un oxyde plus concentré avant la fusion.
- Si votre objectif principal est de produire du ciment : La calcination du calcaire pour produire de la chaux est la première étape fondamentale et non négociable du processus.
- Si votre objectif principal est d'activer un catalyseur : Utilisez la calcination pour obtenir la structure cristalline et la surface idéale nécessaires à une réactivité chimique élevée.
En fin de compte, la calcination est une technique fondamentale en science des matériaux pour modifier délibérément la composition chimique et la structure d'un solide par la chaleur.
Tableau récapitulatif :
| Aspect clé | Description |
|---|---|
| Objectif principal | Décomposition thermique et purification sans fusion |
| Température | Chauffé en dessous du point de fusion du matériau |
| Atmosphère | Air/oxygène limité ou absent pour éviter l'oxydation |
| Intrants courants | Calcaire (CaCO₃), minerais, hydrates |
| Extrants courants | Chaux (CaO), oxydes purifiés, catalyseurs activés |
| Applications clés | Production de ciment, traitement des minerais métalliques, activation de catalyseurs |
Prêt à transformer vos matériaux avec précision ?
Le processus de calcination est essentiel pour purifier les minerais, produire du ciment et activer les catalyseurs. KINTEK est spécialisé dans les équipements de laboratoire à haute température nécessaires pour réaliser ces transformations thermiques précises de manière fiable et efficace.
Que vous traitiez des minéraux ou développiez des matériaux avancés, notre expertise en fours de laboratoire et consommables vous assure de disposer des bons outils pour une décomposition contrôlée et des transitions de phase.
Contactez nos experts en traitement thermique dès aujourd'hui pour discuter de la manière dont les solutions KINTEK peuvent optimiser votre flux de travail de calcination et améliorer les résultats de vos matériaux.
Guide Visuel
Produits associés
- Four à moufle de four à étuve de 1400℃ pour laboratoire
- Four à moufle de 1800℃ pour laboratoire
- Four à moufle de laboratoire à moufle à levage par le bas
- Four à moufle de 1700℃ pour laboratoire
- Four à tube de laboratoire à haute température de 1400℃ avec tube en alumine
Les gens demandent aussi
- Quelle est la différence entre un four à moufle et un four à chambre ? Choisissez le bon four de laboratoire pour votre application
- Quels sont les différents types de fours de laboratoire ? Trouvez celui qui convient parfaitement à votre application
- Comment la teneur en cendres est-elle déterminée dans un four à moufle ? Maîtriser la méthode d'analyse gravimétrique
- La capacité thermique affecte-t-elle le point de fusion ? Démêler les différences clés dans les propriétés thermiques
- Quelle est la précision d'un four à moufle ? Atteindre un contrôle de ±1°C et une uniformité de ±2°C



















