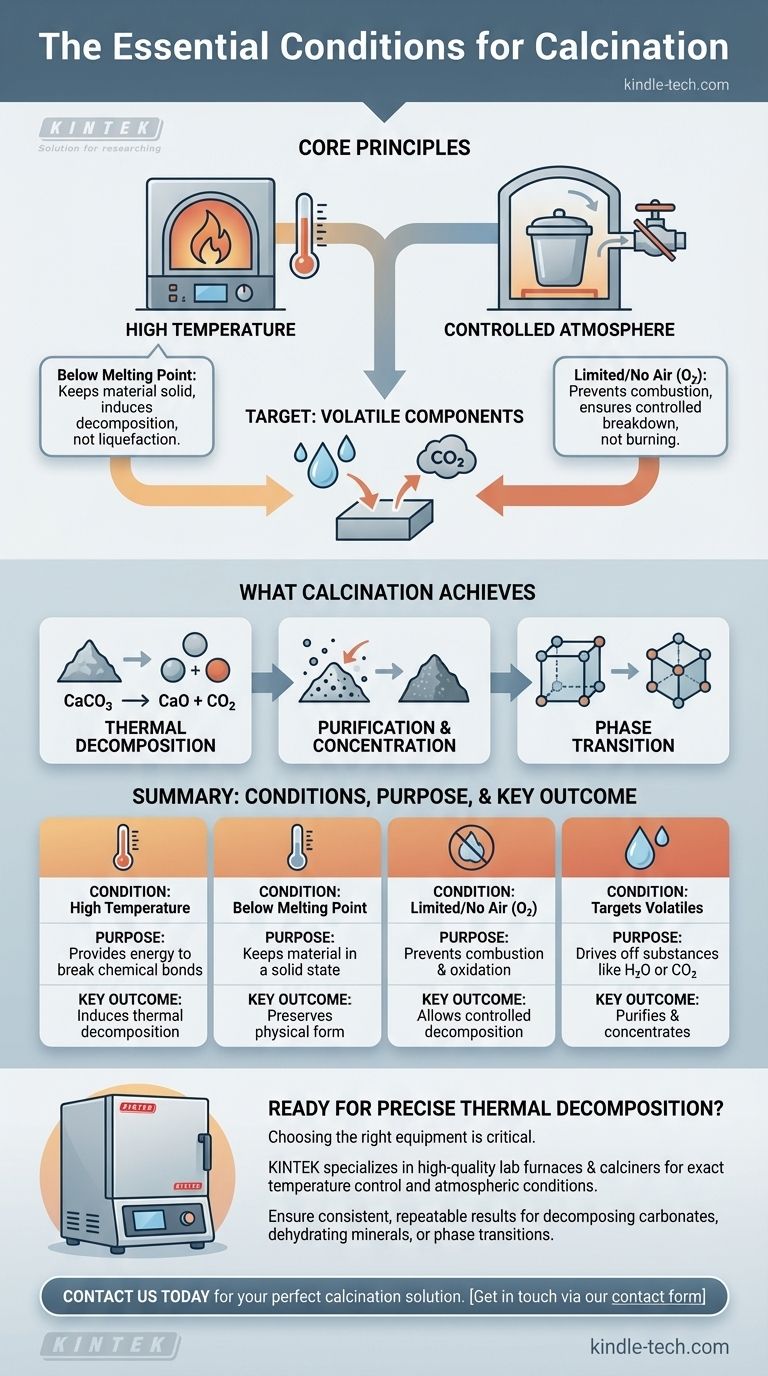
La condition essentielle de la calcination est de chauffer un matériau solide à une température élevée, mais inférieure à son point de fusion, dans un environnement avec un apport limité ou une absence totale d'air. Cet ensemble spécifique de conditions n'est pas destiné à brûler le matériau, mais à induire une décomposition thermique, à éliminer les substances volatiles comme l'eau ou le dioxyde de carbone, ou à déclencher un changement dans la forme physique du matériau.
Le principe fondamental de la calcination est d'utiliser la chaleur pour décomposer une substance, et non pour la brûler. Le contrôle de l'atmosphère en limitant ou en éliminant l'air est le facteur critique qui empêche la combustion et permet cette décomposition contrôlée.

Les principes fondamentaux de la calcination
Pour comprendre la calcination, nous devons examiner ses deux paramètres déterminants : la chaleur et l'atmosphère. Chacun sert un objectif distinct et critique pour obtenir le changement chimique ou physique souhaité.
Le rôle de la température élevée
Le moteur principal du processus est la chaleur. L'application d'une température élevée fournit l'énergie thermique nécessaire pour rompre les liaisons chimiques au sein du matériau solide.
Cependant, cette température doit être soigneusement contrôlée pour rester en dessous du point de fusion de la substance. L'objectif est de modifier un solide, et non de le liquéfier, ce qui changerait fondamentalement la nature du processus et du produit final.
Pourquoi l'atmosphère est-elle contrôlée ?
La condition la plus déterminante de la calcination est l'absence ou l'apport limité d'air (spécifiquement, d'oxygène). C'est ce qui la distingue d'autres processus de traitement thermique comme la torréfaction.
En restreignant l'oxygène, vous empêchez la combustion. L'objectif est de décomposer le matériau uniquement par la chaleur, provoquant la libération des composants sous forme de gaz, plutôt que de le faire réagir avec l'oxygène dans un processus de combustion.
La cible : les composants volatils
La calcination vise spécifiquement à éliminer les fractions volatiles d'une substance. Ce sont des composants qui peuvent être transformés en gaz et éliminés par la chaleur.
Les exemples courants comprennent l'élimination de l'humidité absorbée (H₂O) ou de l'eau chimiquement liée des hydrates, et l'élimination du dioxyde de carbone (CO₂) des minerais carbonatés comme le calcaire.
Ce que la calcination vise à accomplir
Les conditions spécifiques de la calcination sont conçues pour produire plusieurs résultats clés, principalement dans les domaines de la métallurgie et de la science des matériaux.
Décomposition thermique
C'est l'objectif le plus courant. La chaleur est utilisée pour décomposer un composé en substances plus simples. L'exemple classique est la production de chaux (oxyde de calcium) à partir de calcaire (carbonate de calcium).
Lorsqu'il est chauffé, le carbonate de calcium se décompose, libérant du dioxyde de carbone gazeux et laissant derrière lui la chaux solide.
Purification et concentration
En éliminant les impuretés volatiles comme l'eau et le dioxyde de carbone, le solide restant devient plus concentré en l'élément ou le composé désiré. C'est une étape cruciale dans la préparation des minerais pour un traitement ultérieur.
Transition de phase
Dans certaines applications, la chaleur de la calcination est utilisée non pas pour décomposer un matériau, mais pour modifier sa structure cristalline, ou phase. Cela peut altérer les propriétés physiques du matériau, telles que sa dureté ou sa réactivité, le rendant adapté à des utilisations industrielles spécifiques.
L'équipement : Calcinateurs et fours
Ce processus est réalisé dans des réacteurs spécialisés à haute température. Un calciner est un équipement spécialement conçu, souvent un cylindre rotatif, qui permet un contrôle précis à la fois de la température et de l'atmosphère interne, garantissant que les conditions de calcination sont remplies.
Faire le bon choix pour votre objectif
Comprendre les conditions requises vous permet de déterminer quand la calcination est le processus industriel approprié.
- Si votre objectif principal est de décomposer un minerai carbonaté : La calcination est la bonne méthode pour éliminer le dioxyde de carbone et produire un oxyde métallique.
- Si votre objectif principal est d'éliminer l'eau d'un minéral hydraté : Le processus déshydrate efficacement le matériau, concentrant le composé désiré.
- Si votre objectif principal est d'oxyder complètement une substance (comme un minerai sulfuré) : La calcination est le mauvais choix ; vous auriez besoin de torréfaction, qui implique un chauffage en présence d'un excès d'air.
En fin de compte, maîtriser la calcination consiste à appliquer précisément la chaleur dans une atmosphère contrôlée pour obtenir une transformation chimique ou physique spécifique.
Tableau récapitulatif :
| Condition | Objectif | Résultat clé |
|---|---|---|
| Haute température | Fournit l'énergie pour rompre les liaisons chimiques | Induit la décomposition thermique |
| Température inférieure au point de fusion | Maintient le matériau à l'état solide | Préserve la forme physique du produit |
| Air limité ou absent (O₂) | Prévient la combustion et l'oxydation | Permet une décomposition contrôlée, et non une combustion |
| Cible les composants volatils | Élimine des substances comme H₂O ou CO₂ | Purifie et concentre le matériau solide |
Prêt à obtenir une décomposition thermique précise dans votre laboratoire ?
Choisir le bon équipement est essentiel pour une calcination réussie. KINTEK est spécialisé dans les fours de laboratoire et les calciners de haute qualité qui offrent le contrôle précis de la température et les conditions atmosphériques exigées par vos processus.
Que vous décomposiez des carbonates, déshydratiez des minéraux ou étudiiez des transitions de phase, notre équipement fiable garantit des résultats constants et reproductibles.
Contactez-nous dès aujourd'hui pour trouver la solution de calcination parfaite pour les besoins de votre laboratoire. Contactez-nous via notre formulaire de contact et laissez nos experts vous aider à améliorer vos capacités de traitement des matériaux.
Guide Visuel
Produits associés
- Four à moufle de 1700℃ pour laboratoire
- Four à moufle de 1800℃ pour laboratoire
- Four à moufle de four à étuve de 1400℃ pour laboratoire
- Four à moufle de laboratoire à moufle à levage par le bas
- Four à moufle haute température pour déliantage et pré-frittage en laboratoire
Les gens demandent aussi
- Quelles sont les précautions de sécurité pour les expériences thermiques ? Étapes essentielles pour prévenir les brûlures et les accidents en laboratoire
- Le brasage adhère-t-il à la fonte ? Une solution d'assemblage à basse température pour des réparations sans fissures
- Quelles sont les applications du four à moufle dans l'industrie pharmaceutique ? Assurer la pureté et la qualité des médicaments
- Quelle est la différence entre un four à moufle et un incubateur ? Choisissez le bon outil pour votre laboratoire
- Qu'est-ce qui affecte le point de fusion d'une substance ? Découvrez les facteurs et forces clés



















