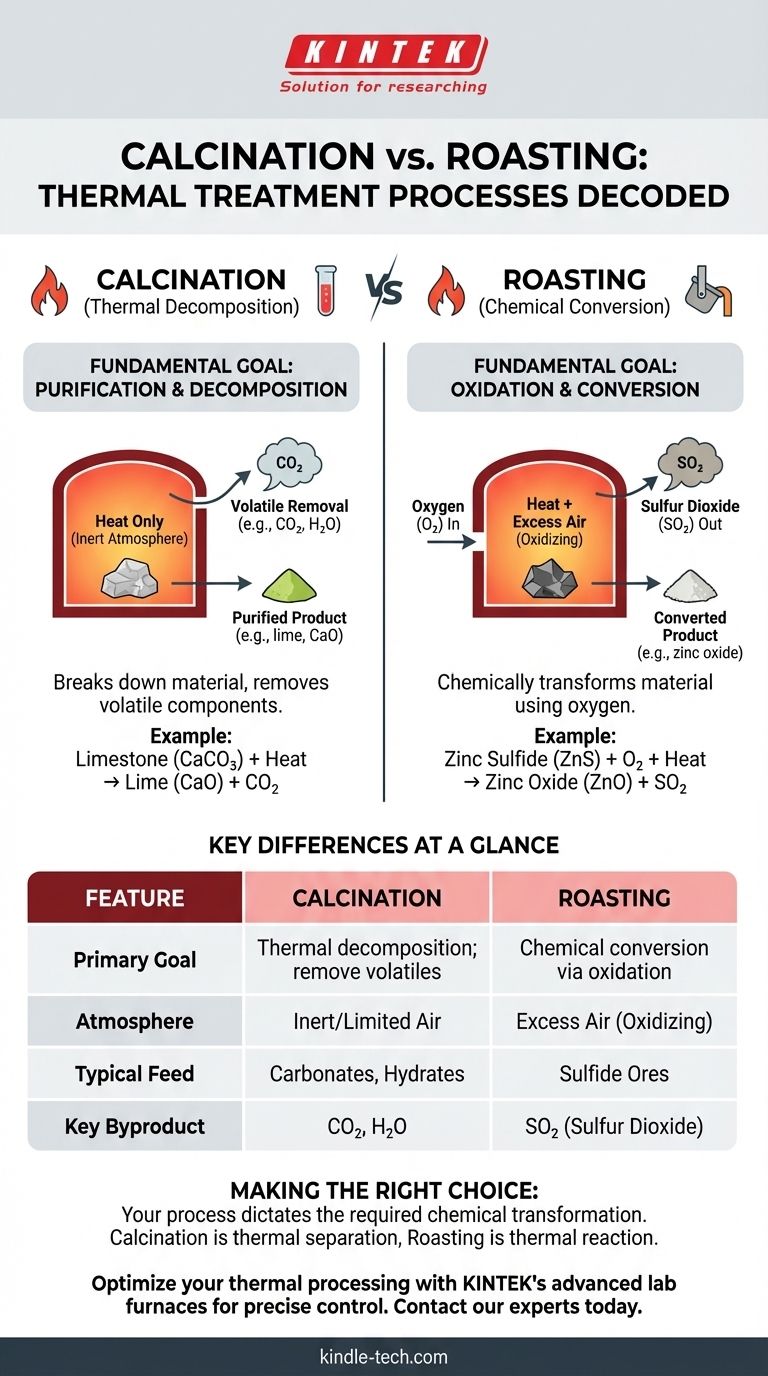
À la base, la différence entre la calcination et la torréfaction réside dans le rôle chimique de l'atmosphère du four. La calcination est un processus de décomposition thermique réalisé en l'absence ou avec un apport limité d'air pour éliminer les substances volatiles. En revanche, la torréfaction est un processus de conversion chimique effectué en présence d'un excès d'air, spécifiquement pour oxyder un matériau, le plus souvent un minerai de sulfure métallique.
Voyez cela de cette façon : la calcination utilise la chaleur pour décomposer une substance et en retirer une partie, comme chasser l'eau d'un solide humide. La torréfaction utilise la chaleur et l'air pour transformer chimiquement la substance entière en quelque chose de nouveau, comme convertir un sulfure en un oxyde.

Décortiquer les procédés : La Calcination
La calcination est une étape de purification et de décomposition purement pilotée par la chaleur. L'objectif est de décomposer le matériau en une forme plus stable ou plus souhaitable en éliminant un composant volatil.
L'objectif fondamental : La Décomposition Thermique
L'objectif principal de la calcination est d'induire une décomposition thermique. Cela signifie utiliser des températures élevées pour rompre les liaisons chimiques et libérer une partie spécifique du composé sous forme de gaz.
Un exemple classique est la production de chaux (oxyde de calcium) à partir de calcaire (carbonate de calcium). La chaleur décompose le carbonate, libérant du dioxyde de carbone.
CaCO₃ (solide) + Chaleur → CaO (solide) + CO₂ (gaz)
Le rôle critique de l'atmosphère
La calcination est définie par son atmosphère, qui est soit inerte, soit dotée d'un apport très limité en air (oxygène). Ceci est crucial car l'objectif est d'éviter l'oxydation ou d'autres réactions indésirables avec l'environnement du four.
Le processus se concentre uniquement sur ce que la chaleur peut faire au matériau lui-même.
Applications courantes de la calcination
Vous rencontrerez la calcination lors de la préparation des matières premières. Ses utilisations comprennent l'élimination de l'eau des hydrates (comme dans le traitement de la bauxite), l'élimination du dioxyde de carbone des carbonates, ou l'élimination de la matière organique volatile de diverses substances.
Décortiquer les procédés : La Torréfaction
La torréfaction est un procédé métallurgique conçu pour modifier chimiquement les minerais métalliques afin de les rendre plus faciles à traiter lors des étapes ultérieures comme la fusion. C'est fondamentalement une réaction avec l'oxygène.
L'objectif fondamental : La Conversion Chimique par Oxydation
L'objectif de la torréfaction est l'oxydation. Le processus fait réagir intentionnellement la matière première, typiquement un minerai de sulfure métallique, avec l'oxygène de l'air.
Ceci convertit le sulfure métallique en un oxyde métallique, qui est plus facilement réduit en métal pur à une étape ultérieure.
2ZnS (solide) + 3O₂ (gaz) + Chaleur → 2ZnO (solide) + 2SO₂ (gaz)
Le rôle critique de l'atmosphère
La torréfaction nécessite une atmosphère oxydante, ce qui signifie qu'un excès d'air ou d'oxygène est fourni au four. L'oxygène n'est pas seulement l'environnement ; c'est un réactif principal dans le processus.
Sans oxygène suffisant, la conversion chimique souhaitée du sulfure en oxyde ne peut pas se produire.
Applications courantes de la torréfaction
La torréfaction est une pierre angulaire de la métallurgie extractive. C'est la méthode principale pour préparer les minerais sulfurés de métaux comme le zinc, le plomb, le cuivre et le nickel à la fusion.
Différences clés en un coup d'œil
Le choix entre la calcination et la torréfaction dépend de votre matière première et du produit final souhaité. Ce sont des outils distincts pour des objectifs chimiques différents.
Objectif
La calcination vise à décomposer un matériau et à éliminer un composant volatil (par exemple, H₂O, CO₂).
La torréfaction vise à convertir chimiquement un matériau par oxydation (par exemple, convertir un sulfure métallique en un oxyde métallique).
Conditions atmosphériques
La calcination se déroule dans une atmosphère inerte, réductrice ou pauvre en oxygène pour éviter l'oxydation.
La torréfaction se déroule dans une atmosphère oxydante avec un excès d'air pour favoriser l'oxydation.
Matières premières traitées
La calcination est généralement utilisée sur les hydrates, les carbonates et les matériaux contenant des composants organiques volatils.
La torréfaction est principalement utilisée sur les minerais sulfurés.
Sous-produits gazeux
La calcination produit principalement des gaz non toxiques comme le dioxyde de carbone (CO₂) et la vapeur d'eau (H₂O).
La torréfaction produit du dioxyde de soufre (SO₂), un polluant important qui doit être capturé et souvent converti en acide sulfurique pour éviter les dommages environnementaux.
Faire le bon choix pour votre objectif
Votre sélection de processus est dictée entièrement par la transformation chimique que vous devez réaliser.
- Si votre objectif principal est de produire de la chaux à partir de calcaire : Vous devez utiliser la calcination pour éliminer le CO₂ sans aucune autre réaction.
- Si votre objectif principal est de préparer du minerai de sulfure de zinc pour la fusion : Vous devez utiliser la torréfaction pour convertir le sulfure (ZnS) en oxyde de zinc (ZnO).
- Si votre objectif principal est d'éliminer l'eau d'hydratation d'un minéral : Vous avez besoin de calcination pour éliminer doucement l'H₂O sans altérer le minéral de base.
- Si votre objectif principal est de créer une charge d'oxyde à partir d'un minerai sulfuré : La torréfaction est l'étape initiale essentielle de votre schéma de traitement métallurgique.
En fin de compte, la distinction est simple : la calcination est une séparation thermique, tandis que la torréfaction est une réaction thermique.
Tableau récapitulatif :
| Caractéristique | Calcination | Torréfaction |
|---|---|---|
| Objectif principal | Décomposition thermique ; éliminer les substances volatiles | Conversion chimique par oxydation |
| Atmosphère | Air inerte ou limité (pauvre en oxygène) | Excès d'air (oxydant) |
| Matière première typique | Carbonates (ex: calcaire), hydrates | Minerais sulfurés (ex: sulfure de zinc) |
| Sous-produit clé | CO₂, H₂O (vapeur d'eau) | SO₂ (dioxyde de soufre) |
Prêt à optimiser votre traitement thermique ?
Que votre objectif soit une décomposition thermique précise ou une oxydation contrôlée, les fours de laboratoire avancés de KINTEK offrent le contrôle atmosphérique et l'uniformité de température exacts dont vous avez besoin. Nos équipements sont conçus pour la fiabilité et la précision dans des applications exigeantes telles que la purification des matériaux et la métallurgie extractive.
Laissez KINTEK être votre partenaire au laboratoire. Nous sommes spécialisés dans les équipements durables et haute performance sur lesquels les laboratoires de recherche et de contrôle qualité comptent.
Contactez nos experts dès aujourd'hui pour discuter de vos exigences spécifiques en matière de traitement thermique et trouver la solution parfaite pour votre processus.
Guide Visuel
Produits associés
- Fourneuse de pyrolyse de four rotatif électrique Machine calcineuse Petit four rotatif Four rotatif
- Four rotatif continu scellé sous vide Four rotatif
- Petite usine de pyrolyse continue à four rotatif électrique pour le chauffage
- Four de régénération électrique pour charbon actif à four rotatif
- Four à atmosphère contrôlée à bande transporteuse
Les gens demandent aussi
- Quel équipement est utilisé dans la pyrolyse ? Choisir le bon réacteur pour votre matière première et vos produits
- Quels sont les produits de la pyrolyse du bois ? Un guide sur les rendements en biochar, bio-huile et gaz de synthèse
- Quelle est la différence entre la calcination et la torréfaction ? Un guide sur le traitement à haute température
- Quelles sont les zones d'un four rotatif dans la production de ciment ? Maîtrisez le processus de base pour un clinker de haute qualité
- Quelle biomasse est utilisée en pyrolyse ? Sélectionner la matière première optimale pour vos objectifs



















