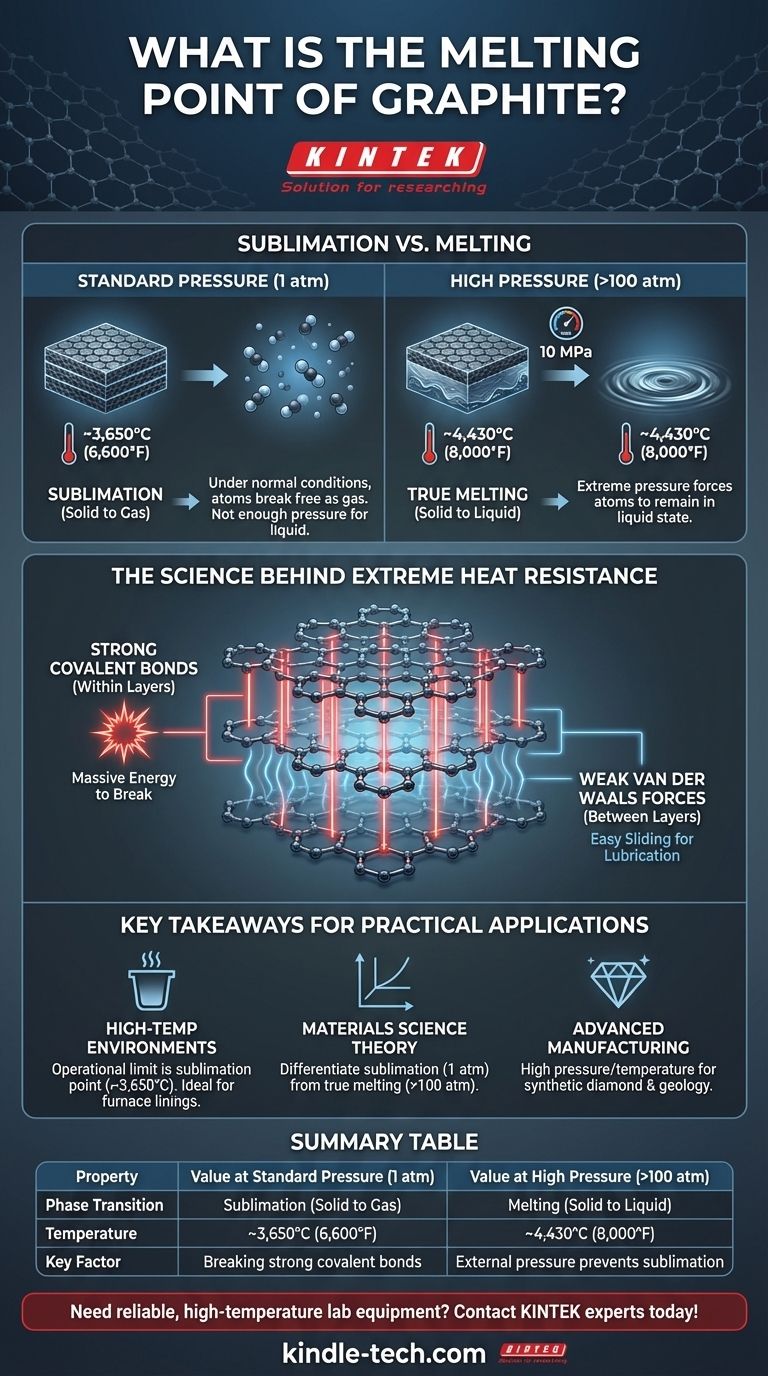
Dans des conditions normales, le graphite ne fond pas. Au lieu de se transformer en liquide, il se sublime – passant directement de l'état solide à l'état gazeux – à environ 3 650 °C (6 600 °F). Une véritable fusion ne se produit que sous une pression extrême, qui force les atomes de carbone à rester à l'état liquide à une température beaucoup plus élevée.
L'immense stabilité thermique du graphite n'est pas un accident de sa composition, mais une conséquence directe de sa structure atomique. Les liaisons covalentes exceptionnellement fortes qui maintiennent les atomes de carbone ensemble en feuillets nécessitent une quantité massive d'énergie pour être rompues, ce qui se traduit par l'un des points de sublimation les plus élevés de tous les éléments.

La science derrière la résistance extrême du graphite à la chaleur
Pour comprendre pourquoi le graphite est si résistant à la chaleur, nous devons examiner comment ses atomes de carbone sont arrangés et liés entre eux.
Le pouvoir des liaisons covalentes
Le graphite est un allotrope du carbone, ce qui signifie qu'il est l'une des plusieurs formes physiques que l'élément peut prendre. Sa structure se compose de plans bidimensionnels plats d'atomes de carbone arrangés en un réseau hexagonal.
Dans chacun de ces plans (une seule couche est appelée graphène), chaque atome de carbone est lié à trois autres par des liaisons covalentes extrêmement fortes. Ce sont ces liaisons qui confèrent au graphite son incroyable stabilité thermique. Les rompre nécessite une quantité d'énergie énorme, ce qui se traduit directement par une température très élevée.
Couches vs. Liaisons : Une distinction clé
Un point de confusion courant est l'utilisation du graphite comme lubrifiant. S'il est si fort, pourquoi est-il aussi glissant ?
La réponse réside dans la différence entre les forces au sein des couches et les forces entre elles. Alors que les liaisons covalentes au sein de chaque feuille de graphène sont puissantes, les liaisons qui maintiennent les feuilles séparées sont de très faibles forces de van der Waals.
Ces faibles forces intercouches permettent aux plans de glisser facilement les uns sur les autres, créant l'effet lubrifiant du graphite. Cependant, faire fondre ou sublimer le matériau nécessite de rompre les fortes liaisons covalentes à l'intérieur des couches, et non les faibles liaisons entre elles.
Fusion vs. Sublimation : Une distinction critique
Les termes "point de fusion" et "point de sublimation" sont souvent utilisés de manière interchangeable pour le graphite, mais ils décrivent des phénomènes physiques différents qui se produisent dans des conditions très différentes.
Sublimation à pression standard
À la pression atmosphérique standard (1 atm), il n'y a pas assez de force pour maintenir les atomes de carbone ensemble dans une phase liquide lorsqu'ils gagnent de l'énergie thermique.
Au lieu que les liaisons se relâchent suffisamment pour former un liquide, les atomes acquièrent tellement d'énergie qu'ils se libèrent complètement de la structure solide et s'échappent sous forme de gaz. Cette transition directe du solide au gaz est la sublimation.
Véritable fusion à haute pression
Pour forcer le graphite à fondre, vous devez appliquer une pression immense. Le point triple du carbone – la condition spécifique où le solide, le liquide et le gaz peuvent coexister – se produit à une pression d'environ 10 mégapascals (MPa), soit environ 100 fois la pression atmosphérique normale.
Dans ces conditions, la pression externe empêche les atomes de carbone de se disperser en gaz. Au lieu de cela, ils passent à l'état liquide à une température d'environ 4 430 °C (8 000 °F). C'est le véritable point de fusion du graphite.
Points clés pour les applications pratiques
Votre compréhension du comportement du graphite à haute température éclaire directement son utilisation dans la science et l'industrie.
- Si votre objectif principal est les environnements à haute température (par exemple, creusets, revêtements de fours) : Fiez-vous au point de sublimation du graphite comme limite opérationnelle, car la fusion n'est pas une préoccupation sous des pressions normales.
- Si votre objectif principal est la théorie des sciences des matériaux : Différenciez clairement entre le point de sublimation (à 1 atm) et le véritable point de fusion (à >100 atm) pour décrire avec précision le diagramme de phase du carbone.
- Si votre objectif principal est la fabrication avancée ou la géologie : La haute pression et la température requises pour le carbone liquide sont pertinentes pour comprendre des processus tels que la formation de diamants synthétiques et les conditions profondes dans le manteau terrestre.
En fin de compte, la résilience du graphite est le reflet direct des puissantes liaisons covalentes qui forment le bloc de construction fondamental de sa structure.
Tableau récapitulatif :
| Propriété | Valeur à Pression Standard (1 atm) | Valeur à Haute Pression (>100 atm) |
|---|---|---|
| Transition de Phase | Sublimation (Solide à Gaz) | Fusion (Solide à Liquide) |
| Température | ~3 650 °C (6 600 °F) | ~4 430 °C (8 000 °F) |
| Facteur Clé | Rupture des fortes liaisons covalentes dans les feuilles de graphène | La pression externe empêche la sublimation |
Besoin d'équipements de laboratoire fiables et résistants aux hautes températures ? L'exceptionnelle stabilité thermique du graphite le rend idéal pour les revêtements de fours, les creusets et les applications à haute température. Chez KINTEK, nous sommes spécialisés dans les équipements et consommables de laboratoire haut de gamme, fournissant les outils durables dont votre laboratoire a besoin pour fonctionner en toute sécurité et efficacement à des températures extrêmes. Contactez nos experts dès aujourd'hui pour trouver la solution parfaite à vos défis de haute température !
Guide Visuel
Produits associés
- Four de graphitisation sous vide vertical à haute température
- Four de graphitation sous vide à ultra-haute température au graphite
- Four de graphitisation de film de haute conductivité thermique sous vide de graphite
- Four de graphitation continue sous vide de graphite
- Four à tube de laboratoire à haute température de 1400℃ avec tube en alumine
Les gens demandent aussi
- Quels sont les avantages de l'AAS à four en graphite ? Obtenez une sensibilité inégalée pour l'analyse des oligo-éléments
- Quel est le processus de fabrication du graphite isostatique ? Obtenez une uniformité de matériau et des performances inégalées
- Quels sont les avantages du graphite ? Libérez des performances supérieures dans les processus à haute température
- Quelle est la température de fonctionnement maximale du graphite ? Libérez les performances à haute température avec l'atmosphère adéquate
- Qu'est-ce qui est responsable de la conductivité électrique du graphite ? Le pouvoir des électrons délocalisés
- Qu'est-ce qui rend le graphite si spécial ? Découverte de ses propriétés uniques pour les applications extrêmes
- Pourquoi le four au graphite est-il plus sensible que la flamme ? Déverrouiller la détection ultra-trace pour votre laboratoire
- Quel rôle jouent les fours à haute température dans la préparation du graphène via le SiC ? Ingénierie de la précision atomique



















