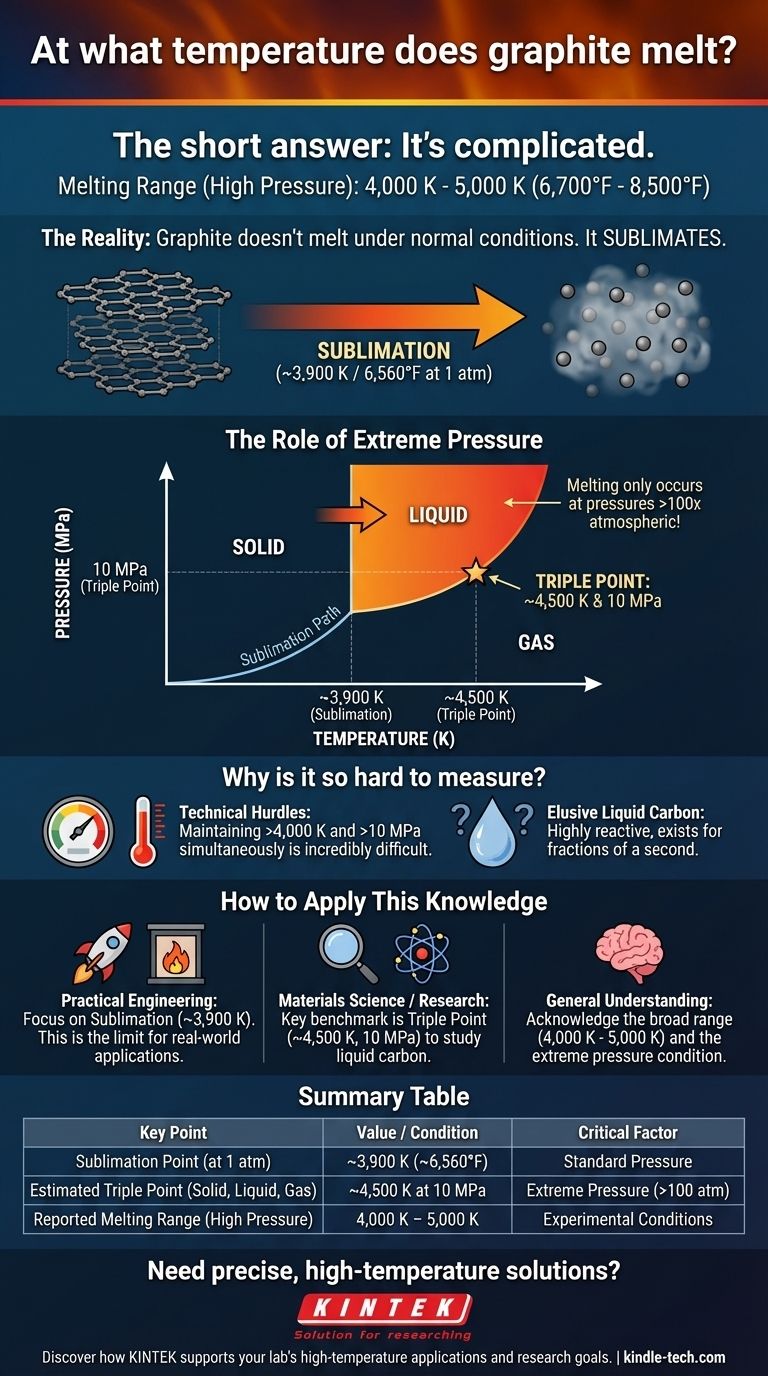
Le point de fusion du graphite n'est pas une valeur unique et fixe. Des décennies d'expériences ont produit un large éventail de résultats, plaçant généralement la température de fusion entre 4 000 K et 5 000 K (environ 6 700°F à 8 500°F). Cette incertitude existe car, dans des conditions normales, le graphite ne fond pas du tout – il se sublime directement d'un solide en un gaz.
Le problème principal est la pression. Pour forcer le graphite à devenir liquide, vous devez appliquer une pression extrême (environ 100 fois la pression atmosphérique normale) tout en le chauffant simultanément à des milliers de degrés. L'immense difficulté technique de ce processus explique pourquoi un point de fusion unique et définitif reste insaisissable.

Pourquoi le graphite résiste à la fusion
Pour comprendre le défi de la fusion du graphite, nous devons regarder au-delà de la température et considérer le rôle fondamental de la pression.
Le problème de la sublimation
À pression atmosphérique standard, les matériaux ont un chemin clair du solide au liquide au gaz à mesure que la température augmente. Le graphite est différent.
Ses atomes sont maintenus ensemble par des liaisons covalentes si fortes que, lorsqu'ils sont chauffés, ils acquièrent suffisamment d'énergie pour se libérer entièrement, se transformant directement en gaz. Ce processus est appelé sublimation. Pour le graphite, cela se produit à environ 3 900 K (6 560°F).
Le rôle de la pression extrême
Pour empêcher la sublimation et forcer le graphite à l'état liquide, une pression immense est requise. Cette relation entre la température, la pression et l'état (solide, liquide, gaz) est décrite par le diagramme de phase d'un matériau.
La caractéristique clé est le point triple : la combinaison spécifique de température et de pression où les phases solide, liquide et gazeuse peuvent toutes exister en équilibre. Pour le graphite, le point triple est estimé à environ 4 500 K et 10 mégapascals (MPa), ce qui est près de 100 fois la pression atmosphérique standard.
Ce n'est qu'à des pressions supérieures à ce point triple qu'une phase de carbone liquide distincte peut exister.
Le défi de la mesure précise
Les conditions extrêmes requises pour atteindre le point triple du graphite sont la raison principale des données expérimentales contradictoires.
Obstacles techniques
Maintenir et mesurer avec précision une température stable de plus de 4 000 K tout en appliquant simultanément plus de 100 atmosphères de pression est à la limite de nos capacités technologiques actuelles.
Différentes méthodes expérimentales, telles que le chauffage laser ou le chauffage par résistance électrique, peuvent produire de légères variations de conditions, conduisant à la large gamme de points de fusion rapportés.
La nature insaisissable du carbone liquide
Même lorsqu'il est obtenu, le carbone liquide est l'un des matériaux les plus exotiques et les plus difficiles à étudier qui existent. Il est très réactif et n'existe que pendant des fractions de seconde dans des conditions contrôlées, ce qui rend l'analyse définitive incroyablement difficile.
Cette incertitude expérimentale n'est pas nouvelle ; c'est un défi scientifique bien documenté qui persiste depuis plus de 60 ans.
Comment appliquer ces connaissances
La "bonne" température pour le changement de phase du graphite dépend entièrement de votre application. Comprendre le contexte est plus important que de mémoriser un seul chiffre.
- Si votre objectif principal est l'ingénierie pratique (fours, tuyères de fusée) : La température de sublimation d'environ 3 900 K à pression standard est la valeur la plus critique. C'est la limite de température pour l'utilisation du graphite dans la plupart des applications réelles à haute température.
- Si votre objectif principal est la science des matériaux ou la recherche en physique : Le point triple d'environ 4 500 K et 10 MPa est le repère clé. Cela représente les conditions minimales dans lesquelles le carbone liquide peut être formé et étudié.
- Si vous avez besoin d'une estimation générale pour la courbe de fusion : Reconnaissez la large plage de 4 000 K à 5 000 K, en comprenant que cela ne se produit que sous des pressions extrêmes et non atmosphériques.
En fin de compte, la stabilité remarquable du graphite à haute température provient de sa préférence à devenir un gaz plutôt qu'à fondre.
Tableau récapitulatif :
| Point clé | Valeur / Condition |
|---|---|
| Point de sublimation (à 1 atm) | ~3 900 K (~6 560°F) |
| Point triple estimé (solide, liquide, gaz) | ~4 500 K à 10 MPa |
| Plage de fusion rapportée (haute pression) | 4 000 K - 5 000 K |
| Facteur critique | Pression extrême (>100 atm) |
Besoin de solutions précises et haute température pour votre laboratoire ?
Le comportement du graphite dans des conditions extrêmes souligne la nécessité d'équipements fiables et performants. Chez KINTEK, nous sommes spécialisés dans la fourniture d'équipements de laboratoire robustes et de consommables conçus pour répondre aux exigences des laboratoires modernes.
Que vous travailliez avec des processus à haute température ou la science des matériaux avancés, nos produits garantissent précision, durabilité et sécurité.
Contactez-nous dès aujourd'hui pour découvrir comment KINTEK peut soutenir les applications haute température et les objectifs de recherche de votre laboratoire.
Guide Visuel
Produits associés
- Four de graphitisation sous vide vertical à haute température
- Four de graphitation sous vide à ultra-haute température au graphite
- Four de graphitation continue sous vide de graphite
- Four de graphitisation de film de haute conductivité thermique sous vide de graphite
- Four à tube de laboratoire à haute température de 1400℃ avec tube en alumine
Les gens demandent aussi
- Pourquoi un four de séchage par atomisation est-il nécessaire lors de la phase de préparation des microsphères de carbone magnétiques Fe3O4@Chitosane (MCM) ?
- L'huile de pyrolyse plastique est-elle meilleure que le diesel ? Un guide pratique du carburant de valorisation des déchets
- Quelle est la différence entre les techniques XRF et XRD ? Un guide pour choisir le bon outil d'analyse
- Qu'est-ce que le traitement thermique en masse ? Obtenir des propriétés matérielles uniformes du cœur à la surface
- Le durcissement par écrouissage affecte-t-il la conductivité ? Comprendre le compromis entre résistance et conductivité
- Comment nettoyer une cible de pulvérisation cathodique ? Obtenez un dépôt de couche mince stable et de haute qualité
- Quelle est la différence entre un four de laboratoire et une étuve de laboratoire ? Choisissez l'outil de chauffage adapté à votre laboratoire
- Quelle est la taille du spot XRF ? Choisissez la bonne taille pour votre analyse



















