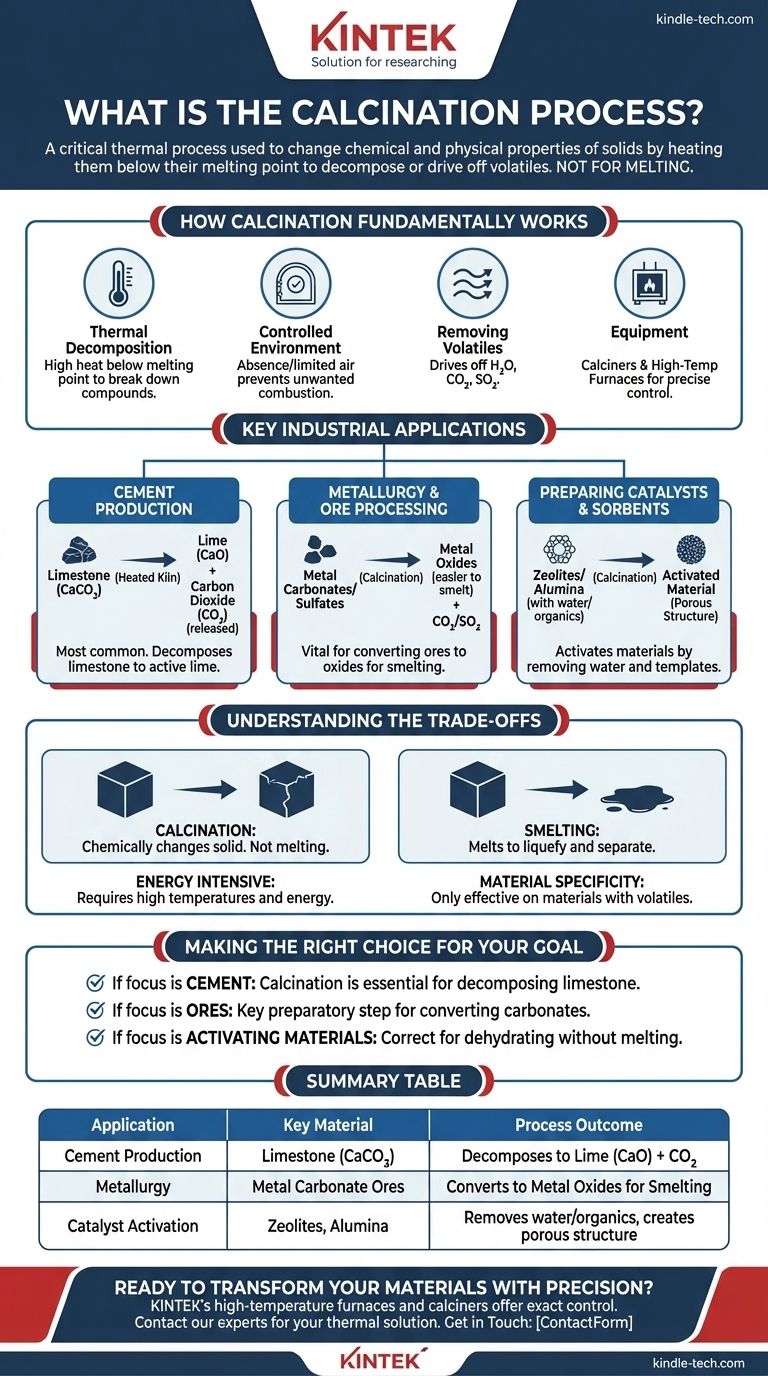
En substance, la calcination est un processus thermique critique utilisé pour modifier les propriétés chimiques et physiques des matériaux solides. Ses principales applications incluent la production de ciment, l'extraction de métaux à partir de minerais, et l'élimination de substances volatiles comme l'eau ou le dioxyde de carbone des solides en les chauffant à une température élevée mais inférieure à leur point de fusion.
L'objectif principal de la calcination n'est pas de faire fondre un matériau, mais d'utiliser une chaleur contrôlée pour le décomposer ou en chasser un composant volatil. Cela altère fondamentalement la substance, la préparant à sa prochaine utilisation industrielle.

Comment fonctionne fondamentalement la calcination
La calcination est une technique de traitement thermique précise. Comprendre ses principes fondamentaux est essentiel pour apprécier sa large gamme d'applications.
Le principe fondamental : la décomposition thermique
Le processus repose sur la décomposition thermique, utilisant une chaleur élevée pour décomposer les composés en substances plus simples. Il est crucial que la température soit maintenue juste en dessous du point de fusion du matériau pour garantir le maintien de la structure solide.
L'environnement contrôlé
La calcination est réalisée en l'absence ou avec un apport limité d'air. Cette atmosphère contrôlée empêche la combustion indésirable et garantit que la décomposition chimique prévue est la réaction primaire qui se produit.
L'objectif principal : éliminer les substances volatiles
L'objectif principal est d'éliminer une fraction volatile du matériau. Cela inclut souvent l'élimination de l'eau chimiquement liée (déshydratation), du dioxyde de carbone des carbonates, ou du dioxyde de soufre des sulfates.
L'équipement : calcinateurs et fours
Ce processus est généralement mené dans un réacteur cylindrique spécialisé appelé calcinateur ou un four à haute température. Ces équipements permettent un contrôle précis de la température et des conditions atmosphériques.
Principales applications industrielles
Les principes de la calcination sont appliqués dans plusieurs industries majeures, souvent comme une étape préparatoire fondamentale.
Production de ciment
C'est l'application la plus courante de la calcination. Le calcaire (carbonate de calcium) est chauffé dans un four, ce qui le décompose en chaux (oxyde de calcium) et en dioxyde de carbone. La chaux résultante est le principal ingrédient actif du ciment.
Métallurgie et traitement des minerais
La calcination est une étape vitale dans l'extraction des métaux à partir de certains minerais. Elle est utilisée pour convertir les carbonates ou sulfates métalliques en leurs oxydes métalliques correspondants, qui sont plus faciles à réduire en métal pur lors des opérations de fusion ultérieures.
Préparation de catalyseurs et de sorbants
Des matériaux comme les zéolithes, l'alumine et le gel de silice sont souvent calcinés pour éliminer l'eau et les gabarits organiques utilisés lors de leur synthèse. Ce processus les active, créant la structure poreuse nécessaire à leur fonctionnement en tant que catalyseurs ou sorbants.
Comprendre les compromis
Bien que puissant, la calcination est un outil spécifique avec des limitations inhérentes qui dictent son utilisation.
Pas un processus de fusion
Il est essentiel de distinguer la calcination de la fusion. La calcination vise à modifier chimiquement le solide lui-même, tandis que la fusion implique de chauffer un matériau bien au-delà de son point de fusion pour le liquéfier et le séparer.
Intensif en énergie
Atteindre et maintenir les températures élevées requises pour la décomposition thermique demande une quantité significative d'énergie. Cela fait de la calcination une partie potentiellement coûteuse et gourmande en ressources d'un processus industriel plus vaste.
Spécificité du matériau
Le processus n'est efficace que sur les matériaux contenant un composant volatil qui peut être éliminé par la chaleur. Ce n'est pas une méthode universelle pour altérer tous les solides ; son utilité est directement liée à la composition chimique du matériau de départ.
Faire le bon choix pour votre objectif
L'application correcte de la calcination dépend entièrement du résultat souhaité pour le matériau.
- Si votre objectif principal est de produire de la chaux pour le ciment : La calcination est le processus essentiel et non négociable pour décomposer le calcaire en oxyde de calcium.
- Si votre objectif principal est de préparer des minerais métalliques pour l'extraction : La calcination est l'étape préparatoire clé pour convertir les minerais carbonatés en oxydes avant la fusion.
- Si votre objectif principal est simplement d'activer un matériau en éliminant l'eau : Un processus de calcination soigneusement contrôlé est l'approche correcte pour déshydrater la substance sans altérer sa structure fondamentale.
En fin de compte, comprendre la calcination permet de la considérer non pas simplement comme un chauffage, mais comme un outil précis et transformateur pour l'ingénierie des matériaux.
Tableau récapitulatif :
| Application | Matériau clé | Résultat du processus |
|---|---|---|
| Production de ciment | Calcaire (CaCO₃) | Se décompose en chaux (CaO) + CO₂ |
| Métallurgie | Minerais de carbonate métallique | Convertit en oxydes métalliques pour la fusion |
| Activation de catalyseur | Zéolithes, alumine | Élimine l'eau/les matières organiques, crée une structure poreuse |
Prêt à transformer vos matériaux avec précision ?
Que vous développiez de nouveaux catalyseurs, traitiez des minerais ou travailliez sur des céramiques avancées, un traitement thermique précis est essentiel. Les fours et calcinateurs haute température de KINTEK sont conçus pour le contrôle exact nécessaire aux processus de calcination réussis.
Nous fournissons des équipements de laboratoire robustes adaptés à vos objectifs de recherche et de production. Contactez nos experts dès aujourd'hui pour trouver la solution thermique parfaite pour votre application.
Contactez-nous pour discuter de vos besoins en calcination
Guide Visuel
Produits associés
- Fourneuse de pyrolyse de four rotatif électrique Machine calcineuse Petit four rotatif Four rotatif
- Petite usine de pyrolyse continue à four rotatif électrique pour le chauffage
- Four rotatif à tubes multiples zones chauffantes divisées
- Four rotatif continu scellé sous vide Four rotatif
- Four de régénération électrique pour charbon actif à four rotatif
Les gens demandent aussi
- Quelle biomasse est utilisée en pyrolyse ? Sélectionner la matière première optimale pour vos objectifs
- Quels sont les types de réacteurs de pyrolyse utilisés dans l'industrie ? Choisissez la bonne technologie pour votre produit
- Quels sont les produits de la pyrolyse du bois ? Un guide sur les rendements en biochar, bio-huile et gaz de synthèse
- Quelles sont les applications industrielles de la pyrolyse ? Transformer les déchets en énergie et en produits de valeur
- Quelle est la différence entre la calcination et la torréfaction ? Un guide sur le traitement à haute température



















