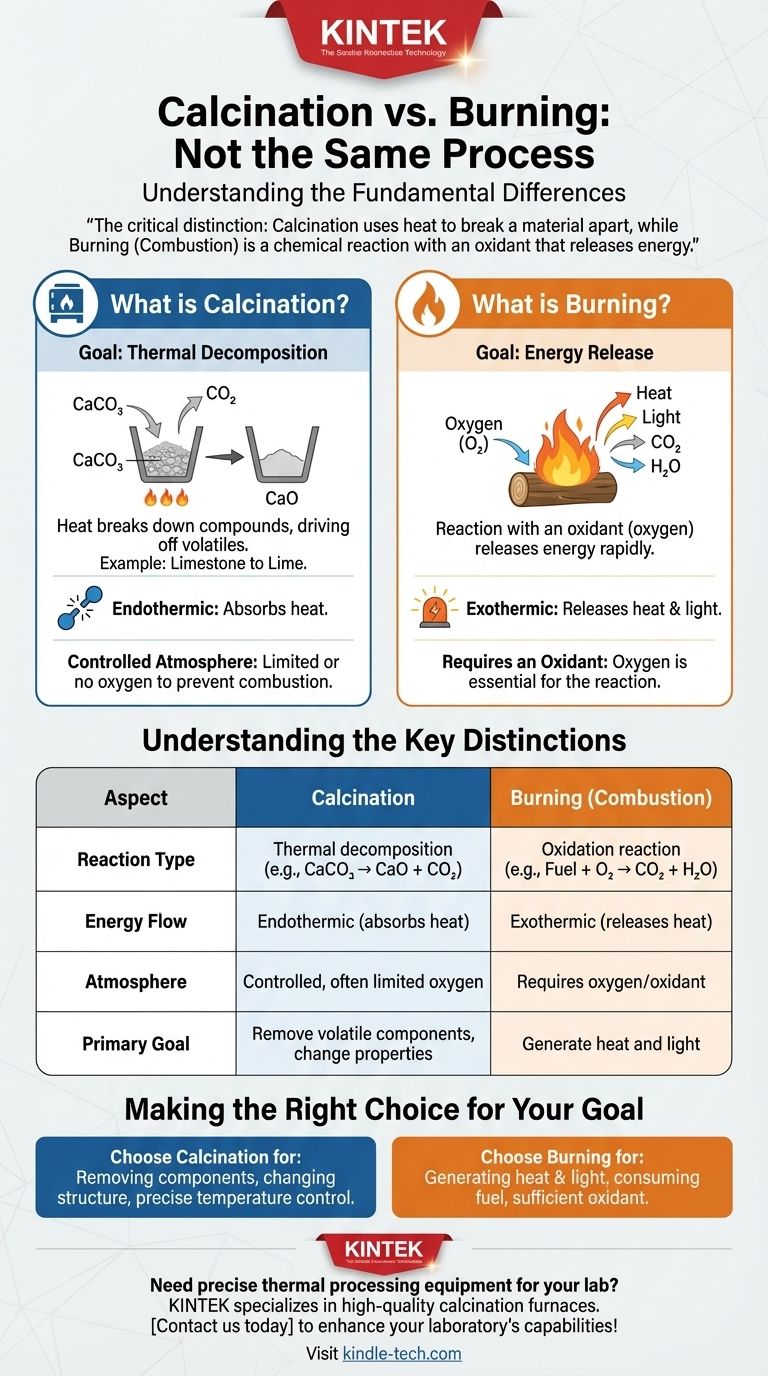
Contrairement à une idée reçue, la calcination n'est pas un processus de combustion. Bien que les deux impliquent des températures élevées, ce sont des transformations chimiques fondamentalement différentes. La calcination est un processus de décomposition thermique, où la chaleur est utilisée pour décomposer un composé, souvent pour éliminer un composant volatil comme le dioxyde de carbone ou l'eau.
La distinction essentielle est la suivante : la calcination utilise la chaleur pour briser un matériau, souvent dans une atmosphère contrôlée, tandis que la combustion est une réaction chimique avec un oxydant comme l'oxygène qui libère de l'énergie.

Qu'est-ce que la calcination ?
La calcination est un traitement thermique précis utilisé pour modifier les propriétés chimiques et physiques d'un matériau. Le terme dérive du latin calcinare, signifiant « brûler la chaux ».
L'objectif : la décomposition thermique
Le but principal de la calcination est de provoquer une décomposition thermique. La chaleur fournit l'énergie nécessaire pour rompre les liaisons chimiques au sein d'une substance, provoquant sa séparation en composants plus simples.
Un exemple courant : la transformation du calcaire en chaux
La production de chaux à partir du calcaire en est l'exemple classique. Lorsque le calcaire (carbonate de calcium, CaCO₃) est chauffé à haute température, il se décompose.
Ce processus élimine le dioxyde de carbone (CO₂) gazeux, laissant derrière lui de la chaux (oxyde de calcium, CaO), un composant crucial dans le ciment et d'autres matériaux industriels.
Le rôle d'une atmosphère contrôlée
De manière cruciale, la calcination a souvent lieu dans une atmosphère avec une quantité limitée ou nulle d'oxygène. Ceci est fait spécifiquement pour empêcher la combustion et garantir que seule la réaction de décomposition souhaitée se produit.
En quoi cela diffère-t-il de la combustion ?
La combustion, connue chimiquement sous le nom de combustion, est une réaction exothermique à haute température entre un combustible et un oxydant, le plus souvent l'oxygène de l'air.
La nécessité d'un oxydant
Contrairement à la calcination, la combustion ne peut pas se produire sans un oxydant. Lorsque vous brûlez du bois, les composés organiques du bois ne font pas que se décomposer ; ils réagissent activement avec l'oxygène.
L'objectif : la libération d'énergie
Le résultat principal de la combustion est la libération rapide d'énergie sous forme de chaleur et de lumière. Bien qu'elle produise également de nouvelles substances chimiques (comme des cendres, du dioxyde de carbone et de la vapeur d'eau), la libération d'énergie en est la caractéristique déterminante.
Comprendre les distinctions clés
Confondre ces deux processus peut entraîner des erreurs importantes dans le traitement des matériaux, la chimie et l'ingénierie. Les différences sont claires et absolues.
Type de réaction
La calcination est une réaction de décomposition. Un seul composé se décompose en deux produits ou plus plus simples (par exemple, CaCO₃ → CaO + CO₂).
La combustion est une réaction d'oxydation. Un combustible réagit avec un oxydant pour former de nouveaux produits oxydés (par exemple, CH₄ + 2O₂ → CO₂ + 2H₂O).
Flux d'énergie
La calcination est généralement un processus endothermique. Elle nécessite un apport continu d'énergie (chaleur) pour maintenir la réaction et rompre les liaisons chimiques.
La combustion est un processus exothermique. Une fois initiée, elle libère beaucoup plus d'énergie qu'il n'en a fallu pour la démarrer, créant une réaction auto-entretenue.
Faire le bon choix pour votre objectif
Comprendre si vous devez calciner ou combuster est fondamental pour atteindre le résultat souhaité dans tout processus thermique.
- Si votre objectif principal est d'éliminer un composant spécifique d'un solide (comme l'eau ou le CO₂) ou de modifier sa structure cristalline : Vous effectuez une calcination, où le contrôle précis de la température et la gestion de l'atmosphère sont critiques.
- Si votre objectif principal est de générer de la chaleur et de la lumière en consommant un combustible : Vous effectuez une combustion, où assurer un approvisionnement suffisant en un oxydant comme l'air est la principale priorité.
Distinguer ces deux processus fondamentaux est essentiel pour contrôler les réactions chimiques et concevoir des matériaux efficacement.
Tableau récapitulatif :
| Aspect | Calcination | Combustion |
|---|---|---|
| Type de réaction | Décomposition thermique | Réaction d'oxydation |
| Flux d'énergie | Endothermique (absorbe la chaleur) | Exothermique (libère de la chaleur) |
| Atmosphère | Contrôlée, oxygène souvent limité | Nécessite de l'oxygène/oxydant |
| Objectif principal | Éliminer les composants volatils, modifier les propriétés du matériau | Générer de la chaleur et de la lumière |
Besoin d'équipements de traitement thermique précis pour votre laboratoire ? KINTEK se spécialise dans les fours de calcination de haute qualité et les équipements de laboratoire conçus pour la décomposition thermique contrôlée. Nos solutions garantissent un contrôle précis de la température et une gestion de l'atmosphère pour la transformation des matériaux. Contactez-nous dès aujourd'hui pour améliorer les capacités de votre laboratoire !
Guide Visuel
Produits associés
- Four rotatif à tubes multiples zones chauffantes divisées
- Four rotatif continu scellé sous vide Four rotatif
- Four rotatif à vide de laboratoire Four rotatif à tube
- Four de régénération électrique pour charbon actif à four rotatif
- Four tubulaire de traitement thermique rapide (RTP) de laboratoire
Les gens demandent aussi
- Quel est le processus de calcination des minerais ? Purification et concentration des métaux pour la fusion
- Quelle est la chaleur requise pour la calcination ? Un guide pour des calculs énergétiques précis
- Quels sont les avantages de la calcination ? Purifiez, activez et stabilisez vos matériaux
- Qu'est-ce que le processus industriel de pyrolyse ? Transformer les déchets en ressources précieuses
- Quels sont les avantages de la pyrolyse des plastiques ? Transformer les déchets en carburant et en nouveaux matériaux
- Quelle est la plage de température pour la pyrolyse rapide ? Optimiser le rendement en bio-huile à partir de la biomasse
- Qu'est-ce que le processus de pyrolyse et de combustion ? Un guide sur la décomposition thermique vs la combustion
- Quelles sont les méthodes de production de bio-huile ? Le guide définitif de la pyrolyse et des procédés alternatifs de biocarburants



















