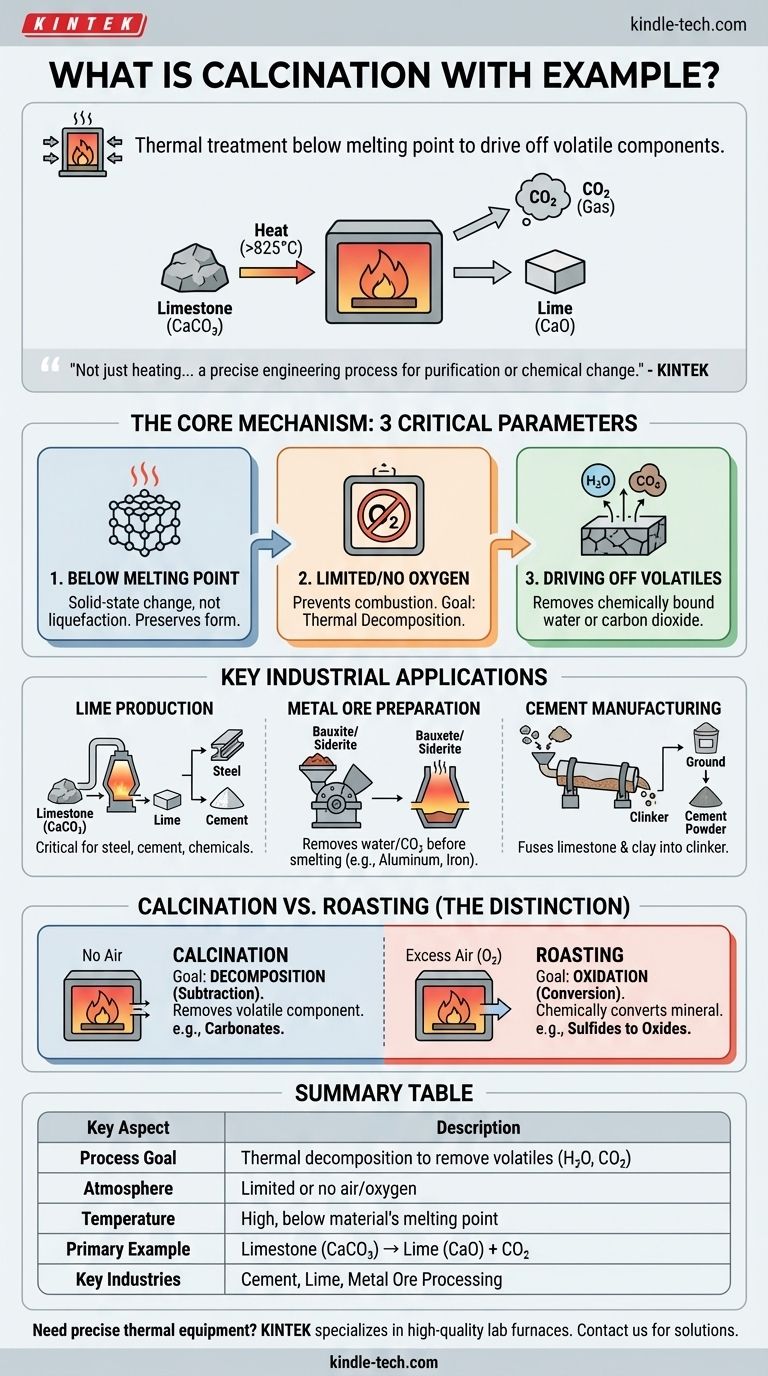
À la base, la calcination est un processus de traitement thermique au cours duquel un matériau solide est chauffé à une température élevée, inférieure à son point de fusion, en l'absence ou avec un apport limité d'air. Ce chauffage contrôlé n'a pas pour but de faire fondre la substance, mais de provoquer une décomposition thermique, chassant les composants volatils. L'exemple le plus courant est le chauffage du calcaire (carbonate de calcium) pour produire de la chaux (oxyde de calcium) et libérer du dioxyde de carbone gazeux.
La calcination ne consiste pas simplement à chauffer quelque chose. C'est un processus d'ingénierie précis conçu pour purifier un matériau ou modifier sa composition chimique en utilisant la chaleur pour rompre les liaisons et éliminer des substances volatiles spécifiques comme l'eau ou le dioxyde de carbone.

Le mécanisme fondamental : que se passe-t-il pendant la calcination ?
La calcination est définie par trois paramètres critiques : la température, l'atmosphère et le changement chimique résultant. Comprendre chacun d'eux est essentiel pour saisir le processus.
Chauffage en dessous du point de fusion
La température est élevée suffisamment pour rompre les liaisons chimiques, mais elle est intentionnellement maintenue en dessous du point de fusion du matériau. L'objectif est d'induire un changement au sein de l'état solide, et non de le liquéfier.
Cela préserve la forme solide du matériau tout en modifiant sa composition chimique, le rendant souvent plus poreux ou plus réactif pour les étapes ultérieures.
Oxygène limité ou absent
Le processus se déroule dans un environnement avec très peu ou pas d'oxygène. C'est une distinction cruciale par rapport aux autres processus de traitement thermique.
Le manque d'oxygène empêche la combustion ou l'oxydation. L'objectif est la décomposition thermique (décomposition par la chaleur), et non une réaction avec l'air ambiant.
Élimination des substances volatiles
Le but principal de la calcination est d'éliminer une fraction volatile du solide. Cela implique généralement d'éliminer l'eau chimiquement liée (hydrates) ou le dioxyde de carbone (provenant des carbonates).
Par exemple, lorsque le calcaire (CaCO₃) est calciné, la chaleur le décompose en chaux solide (CaO) et en dioxyde de carbone gazeux (CO₂), qui s'échappe.
Applications industrielles clés
La calcination est un processus fondamental dans plusieurs industries majeures, utilisée pour préparer des matériaux à un traitement ultérieur ou pour créer un produit fini.
Production de chaux à partir de calcaire
C'est l'exemple par excellence. Le calcaire est chauffé à plus de 825 °C (1517 °F), provoquant la réaction : CaCO₃(s) → CaO(s) + CO₂(g).
Le produit résultant, la chaux (CaO), est un composant essentiel dans la fabrication de l'acier, du ciment et de nombreux processus chimiques.
Préparation des minerais métalliques
En métallurgie, la calcination est une étape préparatoire courante avant la fusion. Elle élimine l'eau des minerais hydratés comme la bauxite (minerai d'aluminium) ou la sidérite (minerai de fer).
Elle élimine également le dioxyde de carbone des minerais carbonatés comme la smithsonite (ZnCO₃) ou la calamine (un mélange de minerais de zinc), rendant l'extraction métallique ultérieure plus efficace.
Fabrication du ciment
La production de ciment Portland implique le chauffage d'un mélange de calcaire et d'argile dans un four à environ 1450 °C (2640 °F).
Ce processus de calcination élimine le CO₂ et fusionne chimiquement les matériaux en une nouvelle substance appelée « clinker ». Le clinker est ensuite broyé en la poudre fine que nous connaissons sous le nom de ciment.
Comprendre la distinction clé : Calcination vs Grillage
Beaucoup de gens confondent la calcination avec le grillage (roasting), un autre processus à haute température utilisé en métallurgie. La différence réside dans les conditions atmosphériques et la réaction chimique visée.
L'objectif de la calcination : Décomposition
Comme établi, la calcination utilise la chaleur en l'absence d'air pour décomposer un composé. C'est un processus de soustraction, où un composant volatil est retiré du minerai.
L'objectif du grillage : Oxydation
Le grillage, en revanche, est effectué en excès d'air. Son objectif est de convertir chimiquement un minéral en un nouvel état par oxydation. Une utilisation courante est la conversion des minerais sulfurés en oxydes plus facilement traités (par exemple, 2ZnS + 3O₂ → 2ZnO + 2SO₂).
Faire le bon choix pour votre analyse
Pour identifier correctement le processus que vous observez, concentrez-vous sur les intrants et le résultat souhaité.
- Si l'objectif principal est d'éliminer l'eau ou le CO₂ d'un carbonate ou d'un hydrate : Vous observez une calcination, qui utilise la chaleur pour décomposer thermiquement un composé.
- Si l'objectif principal est de faire réagir un minerai sulfuré avec de l'oxygène pour former un oxyde : Vous observez un grillage, qui exploite à la fois la chaleur et l'excès d'air pour déclencher l'oxydation.
- Si l'objectif principal est de produire du clinker de ciment ou de la chaux industrielle : Vous observez l'une des applications les plus répandues et les plus critiques de la calcination.
Comprendre cette différence fondamentale entre la décomposition thermique (calcination) et l'oxydation (grillage) est la clé pour maîtriser ces processus industriels fondamentaux.
Tableau récapitulatif :
| Aspect clé | Description |
|---|---|
| Objectif du processus | Décomposition thermique pour éliminer les substances volatiles (ex. : H₂O, CO₂) |
| Atmosphère | Air/oxygène limité ou absent |
| Température | Élevée, mais inférieure au point de fusion du matériau |
| Exemple principal | Calcaire (CaCO₃) → Chaux (CaO) + Dioxyde de carbone (CO₂) |
| Industries clés | Production de ciment, fabrication de chaux, traitement des minerais métalliques |
| Processus contrasté | Grillage (utilise un excès d'air pour l'oxydation) |
Besoin d'un équipement de traitement thermique précis pour votre laboratoire ou votre ligne de production ?
La calcination est une étape critique dans de nombreuses applications industrielles et de recherche, nécessitant un équipement de chauffage fiable et précis. KINTEK est spécialisée dans les fours de laboratoire de haute qualité et les solutions de traitement thermique conçues pour des processus tels que la calcination, le grillage et plus encore.
Nos équipements offrent le contrôle précis de la température et les conditions atmosphériques nécessaires pour obtenir des résultats constants et de haute pureté, que vous traitiez des minéraux, synthétisiez des matériaux ou développiez de nouveaux produits.
Contactez KINTEK dès aujourd'hui pour discuter de la manière dont nos équipements thermiques spécialisés peuvent améliorer l'efficacité et la précision de vos flux de travail de traitement des matériaux.
Guide Visuel
Produits associés
- Fourneuse de pyrolyse de four rotatif électrique Machine calcineuse Petit four rotatif Four rotatif
- Petite usine de pyrolyse continue à four rotatif électrique pour le chauffage
- Four rotatif continu scellé sous vide Four rotatif
- Four rotatif à tubes multiples zones chauffantes divisées
- Four de régénération électrique pour charbon actif à four rotatif
Les gens demandent aussi
- Quelle est la différence entre la calcination et la torréfaction ? Un guide sur le traitement à haute température
- Quel est le principe du four rotatif ? Maîtriser le traitement thermique continu
- Quels sont les produits de la pyrolyse du bois ? Un guide sur les rendements en biochar, bio-huile et gaz de synthèse
- Quel équipement est utilisé dans la pyrolyse ? Choisir le bon réacteur pour votre matière première et vos produits
- Quelles sont les applications industrielles de la pyrolyse ? Transformer les déchets en énergie et en produits de valeur



















